Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Phan Ngọc Hiển, Cà Mau năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Phan Ngọc Hiển, Cà Mau năm học 2016 - 2017 là tài liệu tham khảo hay được VnDoc.com sưu tầm nhằm trợ giúp cho quý thầy cô cùng các bạn học sinh trong quá trình ôn tập lại kiến thức môn Hóa học để chuẩn bị cho thi học kì 1. Chúc các bạn đạt điểm cao trong bài kiểm tra sắp tới.
Bộ đề thi học kì I môn Hóa học lớp 10 năm học 2016 - 2017
Đề thi học kì 1 môn Sinh học lớp 10 trường THPT Phan Ngọc Hiển, Cà Mau năm học 2016 - 2017
Đề kiểm tra 45 phút học kì 1 môn Toán lớp 10 trường THPT Phan Ngọc Hiển, Cà Mau năm học 2016 - 2017
|
SỞ GD&ĐT CÀ MAU Trường THPT Phan Ngọc Hiển ĐỀ 1 |
ĐỀ THI HỌC KỲ I, NĂM HỌC 2016 – 2017 Môn thi: HÓA HỌC – Khối 10 Thời gian làm bài: 45 phút (không tính thời gian giao đề) |
I. PHẦN TRẮC NGHIỆM (4 điểm)
Câu 1. Đồng vị là
A. những nguyên tố có cùng số proton
B. những chất có cùng số điện tích hạt nhân nhưng khác số nơtron
C. những nguyên tử có cùng số khối
D. những nguyên tử có cùng điện tích hạt nhân nhưng khác nhau về số khối
Câu 2. Với hai đồng vị 6529Cu và 6329Cu ba đồng vị 168O, 178O, 188O có thể tạo ra bao nhiêu loại phân tử CuO khác nhau:
A. 5 loại B. 6 loại C. 7 loại D. 8 loại
Câu 3. Tổng số hạt proton, nơtron và electron của một nguyên tử X là 34 hạt. Trong đó hạt mang điện dương ít hơn hạt không mang điện là 1. Tìm số khối của X?
A. 11 B. 23 C. 35 D. 46
Câu 4. Cho cấu hình electron nguyên tử của các nguyên tố sau:
a. 1s2 2s2 2p6 3s2 b. 1s2 2s2 2p6 3s2 3p6 4s1
c. 1s2 2s2 2p6 3s2 3p6 d. 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Các nguyên tố kim loại là trường hợp nào sau đây?
A. a, b, c. B. a, b, d. C. b, c, d. D. a, c, d.
Câu 5. Số đơn vị điện tích hạt nhân của nguyên tử Photpho là 15. Trong nguyên tử photpho, số electron ở lớp ngoài cùng là
A. 3 B. 5 C. 12 D. 15
Câu 6: Số electron tối đa ở lớp thứ 3 (lớp M)?
A. 4 B. 16 C. 18 D. 32
Câu 7: Tính bazơ của dãy các hiđroxit: NaOH, Mg(OH)2, Al(OH)3 biến đổi theo chiều nào sau đây:
A. Vừa tăng vừa giảm B. Không thay đổi C. Tăng D. Giảm
Câu 8: Cation X3+ có cấu hình electron lớp ngoài cùng là: 2s22p6. Vị trí của nguyên tố X trong bảng tuần hoàn là:
A. Chu kì 3, nhóm VIA B. Chu kì 4, nhóm IVB
C. Chu kì 3, nhóm IIIA D. Chu kì 4, nhóm IIIB
Câu 9: Nguyên tố R thuộc nhóm VIA. Trong oxit cao nhất, R chiếm 40% về khối lượng. Công thức oxit cao nhất của R là
A. CO B. SO3. C. CO2. D. SO2.
Câu 10. Trong ion K+ có số proton, số electron lần lượt là:
A. 20, 19 B. 18, 19 C. 19, 18 D. 19, 20
Câu 11. Mệnh đề nào sau đây đúng:
A. Nguyên tố Flo có tính kim loại mạnh nhất trong tất cả các nguyên tố.
B. Tính chất hoá học của các nguyên tố trong cùng nhóm khác nhau.
C. Các nguyên tố nhóm IA gồm các kim loại mạnh nhất trong mỗi chu kì.
D. Nguyên tử của các nguyên tố trong chu kì có số electron ngoài cùng giống nhau.
Câu 12: Hai nguyên tố X và Y thuộc hai nhóm A liên tiếp trong một chu kì có tổng số điện tích hạt nhân là 31. X và Y là
A. Si và Cl. B. P và S. C. Al và Ar. D. S và Cl.
Câu 13. Số electron có trong ion NH4+ là
A. 10e B. 18e C. 16e D. 17e
Câu 14. Trong các hợp chất sau đây: HCl, NaF, CO2 và NH3. Hợp chất có liên kết ion là
A. NaF B. HCl C. CO2 D. NH3
Câu 15. Số oxi hóa của Mn trong đơn chất Mn, của Fe trong Fe3+, của S trong SO3, của P trong PO43- lần lượt là:
A. 0, +3, +6, +4 B. 0, +3, +5, +6 C. 0, +3, +6, +5 D. 0, +5, +3, +5
Câu 16. X là nguyên tố có số hiệu nguyên tử bằng 19, Y là nguyên tố có số hiệu nguyên tử bằng 16. Công thức phân tử của hợp chất tạo nên từ hai nguyên tố là:
A. X2Y; liên kết giữa X và Y là liên kết ion
B. X2Y; liên kết giữa X và Y là liên kết cộng hoá trị
C. XY; liên kết giữa X và Y là liên kết ion
D. XY; liên kết giữa X và Y là liên kết ion.
II. PHẦN TỰ LUẬN (6 điểm)
Bài 1: (2 điểm) Viết công thức cấu tạo và công thức electron của NH3; CO2
Bài 2: (4 điểm) Cho nguyên tố X (Z = 8) trong bảng tuần hoàn.
a) Viết cấu hình electron của nguyên tử X. X có tính kim loại hay tính phi kim. Vì sao?
b) Xác định vị trí của X (số thứ tự, chu kì, nhóm) trong bảng tuần hoàn (có giải thích)
c) Y là nguyên tố mà nguyên tử của nó kém nguyên tử X 2 proton. Xác định Y.
d) X và Y kết hợp với nhau tạo thành hợp chất Z, trong đó tỉ lệ khối lượng giữa X và Y là 4 : 3. Tìm công thức phân tử của Z.
Cho nguyên tử khối của các nguyên tố: H = 1; Cl = 35,5; Br = 80; Na = 23; Mg = 24; Li = 7; K = 39; Li = 7; Fe = 56; C = 12; Ag = 107; S = 32; Ba = 137; O = 16; P=31.
Học sinh không được sử dụng BTH
Đáp án đề thi học kì 1 môn Hóa học lớp 10
ĐÁP ÁN ĐỀ 1
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN: (4 điểm)
Mỗi câu trả lời đúng 0,25 điểm
|
Câu hỏi |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
Đáp án |
D |
B |
B |
B |
B |
C |
D |
C |
B |
C |
C |
B |
A |
A |
C |
A |
II. PHẦN TỰ LUẬN: (7 điểm)
Câu 1 (2 đ)
| (CT electron) | (CT cấu tạo) |
| O = C = O | |
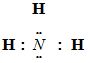 |
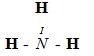 |
Câu 2 (4 đ)
* X (Z = 8)
a. Có 8 electron
- Cấu hình electron X: 1s22s22p4
- Là phi kim.
Vì có 6 electron lớp ngoài cùng
b. Vị trí X
- Ô: 8
- Chu kỳ: 2
- Nhóm: VIA
Giải thích
c. X có 8 proton, Y kém hơn X hai proton
Số proton của Y là 6 proton
Y là cacbon (C)
d. Đặt công thức hợp chất Z là CxOy (x, y > 0)
Theo đề bài ta có: ![]()
→ x = y = 1
Vậy CTPT hợp chất Z là CO



