Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 2
Đề thi học kì 1 Hóa 10 KNTT
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí
ĐỀ 2
ĐỀ THI CUỐI HỌC KỲ I
NĂM HỌC ……..
MÔN: HÓA 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Hạt mang điện trong hạt nhân nguyên tử là
A. proton và electron. B. proton.
C. neutron. D. proton và neutron.
Câu 2. Dãy nào dưới đây gồm các đồng vị của cùng một nguyên tố hóa học?
A.
14 14
67
X, Y
. B.
19 20
9 10
X, Y
. C.
28 29
14 14
X, Y
. D.
40 40
18 19
X, Y
.
Câu 3. Các nguyên tố trong cùng chu kì
A. có cùng số lớp electron.
B. có cùng số electron ở lớp vỏ ngoài cùng của chúng.
C. có tính chất hóa học tương tự nhau.
D. có cùng số điện tích hạt nhân.
Câu 4. Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử. B. Tính kim loại.
C. Độ âm điện. D. Khối lượng nguyên tử.
Câu 5. Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố. B. Tên nguyên tố.
C. Số hiệu nguyên tử. D. Số khối của hạt nhân.
Câu 6. Bảng tuần hoàn hiện nay có số chu kì và số hàng ngang lần lượt là
A. 7 và 9. B. 7 và 8. C. 7 và 7. D. 6 và 7.
Câu 7. Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử thì
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, bán kính nguyên tử giảm dần.
Câu 8. Theo quy tắc bát tử thì nguyên tử có xu hướng đạt cấu trúc bền giống
A. kim loại kiềm gần kề. B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề. D. nguyên tử khí hiếm gần kề.
Câu 9. Trong nguyên tử, electron hóa trị là các electron
A. độc thân. B. ở phân lớp ngoài cùng.
C. ở obital ngoài cùng. D. tham gia tạo liên kết hóa học.
Câu 10. Chọn phương án đúng để hoàn thành các câu sau:
Khi tạo thành các hợp chất ion, … (1) … mất các electron hóa trị của chúng để tạo thành … (2) … mang
điện tích dương và … (3) … nhận các electron hóa trị để tạo thành … (2) … mang điện tích âm.
A. (1) kim loại, (2) anion, (3) phi kim, (4) cation.
B. (1) phi kim, (2) cation, (3) kim loại, (4) anion.
C. (1) kim loại, (2) ion đa nguyên tử, (3) phi kim, (4) anion
D. (1) kim loại, (2) cation, (3) phi kim, (4) anion.
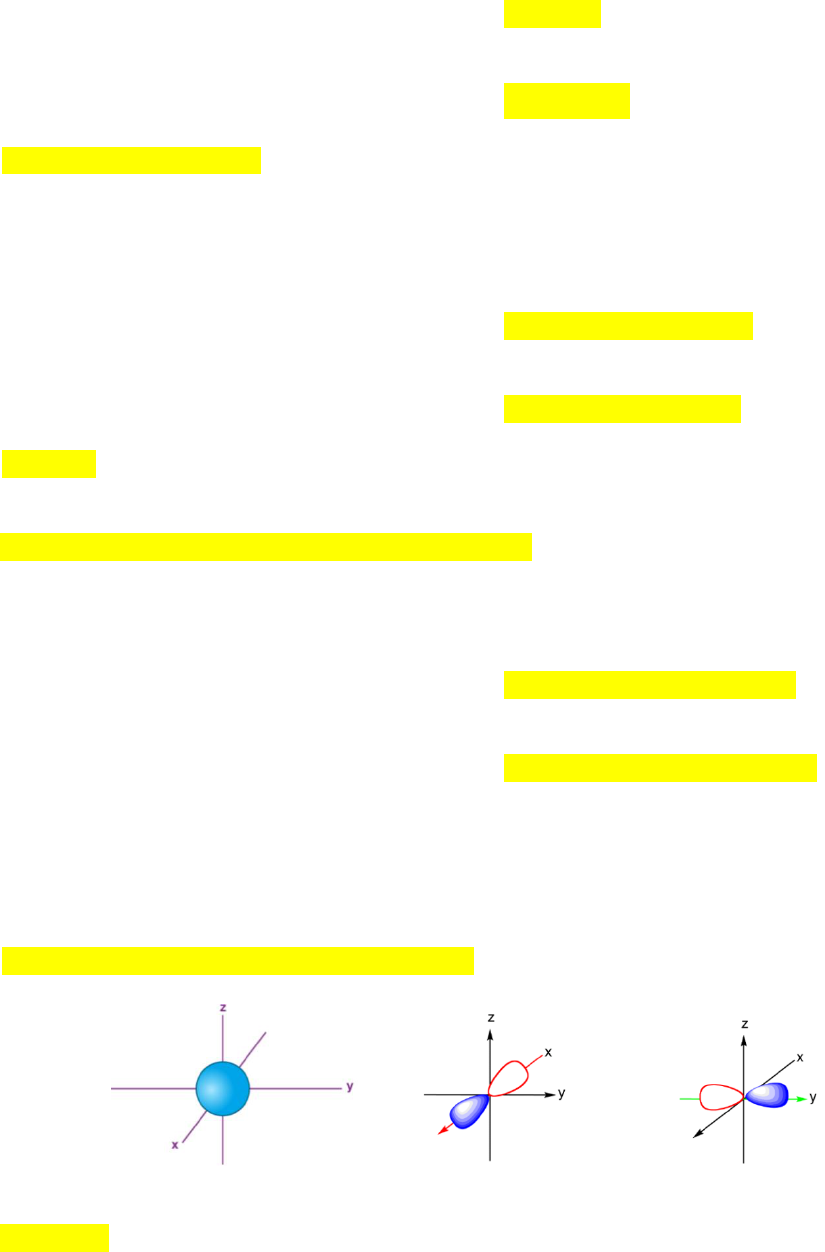
Câu 11. Hình vẽ dưới đây mô tả 3 dạng orbital:
a)
b)
c)
Các orbital tương ứng với các hình a), b) và c) là
A. s, p
x
, p
y
. B. s, p
y
, p
z
. C. s, p
x
, p
z
. D. p
x
, p
y
, p
z
.
Câu 12. Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p? Cho số hiệu
nguyên tử H, N, O, F lần lượt là 1, 7, 8, 9.
A. NH
3
. B. HF. C. O
2
. D. H
2
.
Câu 13. Nguyên tử của nguyên tố X có cấu hình electron 1s
2
2s
2
2p
6
3s
2
, nguyên tử của nguyên tố Y có cấu
hình electron 1s
2
2s
2
2p
5
. Liên kết hoá học giữa nguyên tử X và nguyên tử Y là
A. liên kết kim loại. B. liên kết cộng hoá trị.
C. liên kết ion. D. liên kết cho nhận.
Câu 14. Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các
lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử. B. các electron trong phân tử.
C. các proton trong hạt nhân. D. các neutron và proton trong hạt nhân.
Câu 15. Cấu hình electron hóa trị của nguyên tử R ở trạng thái cơ bản là ns
2
np
1
. Phát biểu nào sau đây là
sai?
A. R thuộc khối nguyên tố p.
B. R nằm ở nhóm IIIA trong bảng tuần hoàn.
C. Công thức oxide cao nhất của R có dạng R
2
O
3
.
D. R là một nguyên tố phi kim.
Câu 16. M là nguyên tố chu kì 3, có khả năng phản ứng mạnh với nước tạo thành dung dịch kiềm MOH.
Cấu hình electron của M là
A. [Ar]4s¹. B. [Ne]3s²3p
5
. C. [Ne]3s
1
. D. [Ne]3s²3p
1
.
Câu 17. Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực?
A. N
2
, CO
2,
Cl
2
, H
2
. B. N
2
, Cl
2
, H
2
, HCl.
C. N
2
, HI, Cl
2
, CH
4
. D. Cl
2
, O
2
, N
2
, F
2
.
Câu 18. Hợp chất khí tạo bởi nguyên tố R với hydrogen là RH. Trong oxide cao nhất, R chiếm 58,86% về
khối lượng. Nguyên tố R là (cho nguyên tử khối của Br = 80, F = 19, I = 127, Cl = 35,5)
A. Br. B. F. C. I. D. Cl.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
Câu 1. Aluminium (Al) là kim loại có nhiều ứng dụng trong thực tiễn, được dùng làm dây dẫn điện, chế
tạo các thiết bị, máy móc trong công nghiệp và nhiều đồ dùng sinh hoạt. Trong bảng tuần hoàn các
nguyên tố hoá học, nguyên tố Al thuộc chu kì 3 và nhóm IIIA.
a. Điện tích hạt nhân của Al là +13.
b. Ở trạng thái cơ bản, nguyên tử Al có 3 electron độc thân.
c. Nguyên tử Al có 3 lớp electron và 3 electron ở lớp ngoài cùng.
d. Theo xu hướng biến đổi tính kim loại, Mg (Z = 12) có tính kim loại yếu hơn Al.
Đáp án:
a. Đúng.
b. Sai. Có 1 electron độc thân.
c. Đúng.
d. Sai. Tính kim loại của Mg mạnh hơn Al trong cùng một chu kì.
Câu 2. Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8.
a. X là kim loại, Y là phi kim.
b. Hợp chất tạo thành giữa nguyên tử X và nguyên tử Y là X
2
Y.
c. Nguyên tử X nhường electron để tạo thành cation X
–
; nguyên tử Y nhận electron để trở thành ion Y
2+
.
d. Liên kết trong hợp chất được tạo thành giữa nguyên tử X và Y là liên kết cộng hóa trị.
Đáp án:
a. Đúng.
b. Đúng. Hợp chất Na
2
O.
c. Sai. X
+
và Y
2–
.
d. Sai. Liên kết ion.
Câu 3. Cho sơ đồ của một nguyên tử X được biễu diễn như sau:

a. X là nguyên tử nguyên tố lithium (Z = 3).
b. Nguyên tử X có bán kính lớn hơn bán kính của nguyên tử của carbon (Z = 6).
c. Trong nguyên tử X, số hạt mang điện nhiều hơn hạt mang điện là 2.
d. Khối lượng của một nguyên tử X gần đúng bằng 7 (amu). Biết khối lượng của một hạt electron, proton,
neutron lần lượt là 0,00055; 1 và 1 amu.
Đáp án:
a. Đúng.
b. Đúng.
c. Đúng.
d. Sai. m
X
xấp xỉ = 3 + 3 + 4 = 8 amu.
Câu 4. Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ liên kết giữa các
phân tử và cung cấp động năng để phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ
thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên
nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì
càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó nhiệt độ nóng chảy và nhiệt độ sôi của
chất đó càng cao.
a. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố: khối lượng phân tử, liên kết giữa
các phân tử.
b. Nhiệt độ nóng chảy, nhiệt độ sôi của H
2
O cao hơn H
2
S là do giữa các phân tử H
2
O có liên kết hydrogen
trong khi đó H
2
S không có.
c. Nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI do giữa các phân tử hydrogen fluoride (HF) có
liên kết hydrogen, còn giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
d. Trong quá trình chưng cất rượu, C
2
H
5
OH bay hơi trước H
2
O mặc dù khối lượng phân tử C
2
H
5
OH lớn
hơn khá nhiều khối lượng phân tử H
2
O là do liên kết hydrogen giữa các phân tử H
2
O bền hơn so với liên
kết hydrogen giữa các phân tử C
2
H
5
OH.
Đáp án:
a. Đúng.
b. Đúng.
c. Đúng.
d. Đúng.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Cho 6 nguyên tố có số hiệu nguyên tử lần lượt là 7, 11, 13, 17 và 19. Trong số các nguyên tố trên,
có bao nhiêu nguyên tố thuộc cùng một nhóm?
Đáp án: 3.
Câu 2. Tổng số cặp electron dùng chung giữa các nguyên tử trong phân tử acetylene (C
2
H
2
) là bao nhiêu?
Đáp án: 5.
Câu 3. Trong dung dịch ethanol (C
2
H
5
OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
Đáp án: 4.
Đề kiểm tra học kì 1 lớp 10 môn Hóa học có đáp án
Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 2 có đáp án được VnDoc.com sưu tầm và xin gửi tới bạn đọc cùng tham khảo. Đề thi được biên soạn theo cấu trúc đề thi tốt nghiệp THPT Quốc gia mới. Đề được tổng hợp gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi trắc nghiệm đúng sai và 6 câu hỏi trắc nghiệm trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây để có thêm tài liệu ôn thi cuối học kì 1 lớp 10 sắp tới nhé.


