Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 3
Đề thi học kì 1 Hóa 10 KNTT
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí
ĐỀ 3
ĐỀ THI CUỐI HỌC KỲ I
NĂM HỌC ……………..
MÔN: HÓA 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Hạt nào sau đây mang điện tích âm và có khối lượng không đáng kể trong nguyên tử?
A. Proton. B. Electron. C. Proton và neutron. D. Neutron.
Câu 2. Cho các nguyên tử X, Y, Z, T có các đặc điểm như sau:
(1) X có 17 proton và số khối bằng 35. (2) Y có 17 neutron và số khối bằng 33.
(3) Z có 17 neutron và 15 proton. (4) T có 20 neutron và số khối bằng 37.
Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
A. X và Y. B. X, Y và Z. C. Y và Z. D. X và T.
Câu 3. Lớp N có bao nhiêu phân lớp electron?
A. 2. B. 3. C. 5. D. 4.
Câu 4. Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron 90%.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 5. Cấu hình electron của nguyên tử Si (Z = 14) là
A.
2 2 6 4
1s 2s 2p 3p
. B.
2 2 5 2 2
1s 2s 2p 3s 3p
. C.
2 2 6 4
1 s 2 s 2p 2 d
. D.
2 2 6 2 1
1s 2s 2p 3s 3p
.
Câu 6. Phân tử nào sau đây có liên kết cộng hóa trị không phân cực?
A. HCl. B. Cl
2
. C. PH
3
. D. H
2
S.
Câu 7. Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 12 và 8. Cho các phát biểu sau:
(a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y.
(b) X là kim loại, Y là phi kim.
(c) Trong các phản ứng hóa học, nguyên tử X có xu hướng nhường 2 electron.
(d) Khi hình thành liên kết với nguyên tử X, nguyên tử Y nhận 1 electron.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 8. Chất nào sau đây tạo được liên kết hydrogen giữa các phân tử?
A. H
2
S. B. H
2
O. C. HCl. D. CH
4
.
Câu 9. Sulfur (S) thuộc nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao
nhất của sulfur là
A. SO
2
. B. SO
3
. C. H
2
SO
3
. D. H
2
SO
4
.
Câu 10. Anion X
–
có cấu hình electron của phân lớp ngoài cùng là 2p
6
. Vị trí của X trong bảng tuần hoàn
là
A. chu kì 2, nhóm VA. B. chu kì 3, nhóm IA.
C. chu kì 2, nhóm VIA. D. chu kì 2, nhóm VIIA.
Câu 11. Trong bảng tuần hoàn các nguyên tố, chu kì 1 và chu kì 3 có số nguyên tố lần lượt là
A. 2 và 6. B. 2 và 8. C. 1 và 6. D. 1 và 8.
Câu 12. Số thứ tự của nhóm (trừ hai cột 9, 10 của nhóm VIIIB) bằng
A. số đơn vị điện tích hạt nhân. B. số lớp electron.
C. số electron hóa trị. D. số electron ở lớp ngoài cùng.
Câu 13. Số liên kết
và liên kết
trong một liên kết ba là
A. 0 và 3. B. 1 và 3 . C. 1 và 2. D. 3 và 1 .
Câu 14. Trong một nhóm của bảng tuần hoàn các nguyên tố hóa học, theo chiều tăng dần điện tích hạt
nhân, bán kính nguyên tử của các nguyên tố giảm dần do số lớp electron ...(I), lực hút giữa hạt nhân với
electron lớp ngoài cùng ...(II). Cụm từ cần điền vào (I), (II) lần lượt là
A. tăng dần, tăng dần. B. giảm dần, giảm dần.
C. giảm dần, tăng dần. D. tăng dần, giảm dần.
Câu 15. Quá trình hình thành phân tử X có sự xen phủ orbital như sau:

Chất X nào sau đây không thỏa mãn? (cho số hiệu nguyên tử H, F, Cl, Br lần lượt là 1, 9, 17, 35)
A. HCl. B. HF. C. HBr. D. Cl
2
.
Câu 16. Liên kết ion được tạo thành giữa hai nguyên tử bằng
A. một hay nhiều cặp electron dùng chung.
B. một hay nhiều cặp electron dùng chung nhưng chỉ do một nguyên tử đóng góp.
C. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
D. một hay nhiều cặp electron dùng chung và cặp electron dùng chung bị lệch về phía nguyên tử có độ
âm điện lớn hơn.
Câu 17. Phát biểu nào sau đây không đúng khi nói về tính chất của hợp chất cộng hoá trị?
A. Nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
B. Tồn tại trạng thái rắn, lỏng hoặc khí ở điều kiện thường.
C. Các hợp chất cộng hóa trị đều dẫn điện tốt.
D. Hợp chất cộng hoá trị không phân cực thường tan tốt trong dung môi không phân cực.
Câu 18. Nếu giữa phân tử chất tan và dung môi có thể tạo thành liên kết hydrogen hoặc có tương tác van
der Waals càng mạnh với nhau thì càng tan tốt vào nhau. Lí do nào sau đây là phù hợp để giải thích dầu
hoả (thành phần chính là hydrocarbon) không tan trong nước?
A. Cả nước và dầu đều là các phân tử có cực.
B. Nước là phân tử phân cực và dầu là không/ít phân cực.
C. Nước là phân tử không phân cực và dầu là phân cực.
D. Cả nước và dầu đều không các phân cực.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
Câu 1. Mỗi phát biểu sau đây về mô hình nguyên tử hiện đại là đúng hay sai?
a. Electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt
nhân.
b. Tất cả các AO nguyên tử đều có hình dạng giống nhau.
c. Mỗi AO nguyên tử chỉ có thể chứa được 1 electron.
d. Các electron s chuyển động trong các AO có hình số tám nổi.
Đáp án:
a. Đúng.
b. Sai. AO s có dạng hình cầu, AO p có dạng hình số tám nổi.
c. Sai. Mỗi AO chứa tối đa 2 electron.
d. Sai. Các electron s chuyển động trong các AO có hình cầu.
Câu 2. Nguyên tử nguyên tố R có cấu hình electron phân lớp cuối cùng là 3p
3
. Cho nguyên tử khối của R
là 31.
a. Công thức hydroxide cao nhất của R là HRO
3
.
b. R có tính phi kim mạnh hơn Si (Z = 14).
c. Nguyên tử R có 5 electron ở phân lớp ngoài cùng.
d. Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hydrrogen là 92,37%.
Đáp án:
a. Sai.
b. Đúng.
c. Sai. Có 3 electron.
d. Sai. %R = 91,18%.
Câu 3. Sodium oxide (Na
2
O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Cho số hiệu nguyên
tử của Na, O, Ne lần lượt là 11, 8 và 10.
a. Trong phân tử Na
2
O, các ion Na
+
và ion O
2–
đều đạt cấu hình electron bền vững của khí hiếm neon.
b. Phân tử Na
2
O được tạo ra bởi lực hút tĩnh điện giữa hai ion Na
+
và một ion O
2–
.
c. Ở điều kiện thường, Na
2
O là chất lỏng.
d. Na
2
O có nhiệt độ nóng chảy thấp hơn magnesium oxide (MgO).
Đáp án:
a. Đúng.
b. Đúng.
c. Sai. Na
2
O là chất rắn.
d. Đúng. Bán kính Na
+
< bán kính Mg
2+
, đồng thời điện tích của Mg
2+
nhiều hơn Na
+
nên MgO có nhiệt
độ nóng chảy cao hơn.
Câu 4. Cho biết năng lượng liên kết H-I, H-Br và H-Cl lần lượt là 299 kJ/mol, 366 kJ/mol, 432 kJ/mol.
a. Khi đun nóng, HI bị phân huỷ (thành H
2
và I
2
) ở nhiệt độ thấp hơn so với HBr (thành H
2
và Br
2
).
b. Phản ứng của Cl
2
với H
2
xảy ra dễ hơn so với phản ứng của Br
2
với H
2
.
c. Khi đun nóng, HCl bị phân huỷ (thành H
2
và Cl
2
) ở nhiệt độ thấp hơn so với HBr (thành H
2
và Br
2
).
d. Độ bền liên kết tăng dần theo thứ tự là HCl, HBr, HI.
Đáp án:
a. Đúng.
b. Đúng.
c. Sai. HCl khó bị phân hủy hơn do năng lượng liên kết lớn hơn.
d. Sai. Theo chiều giảm dần.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
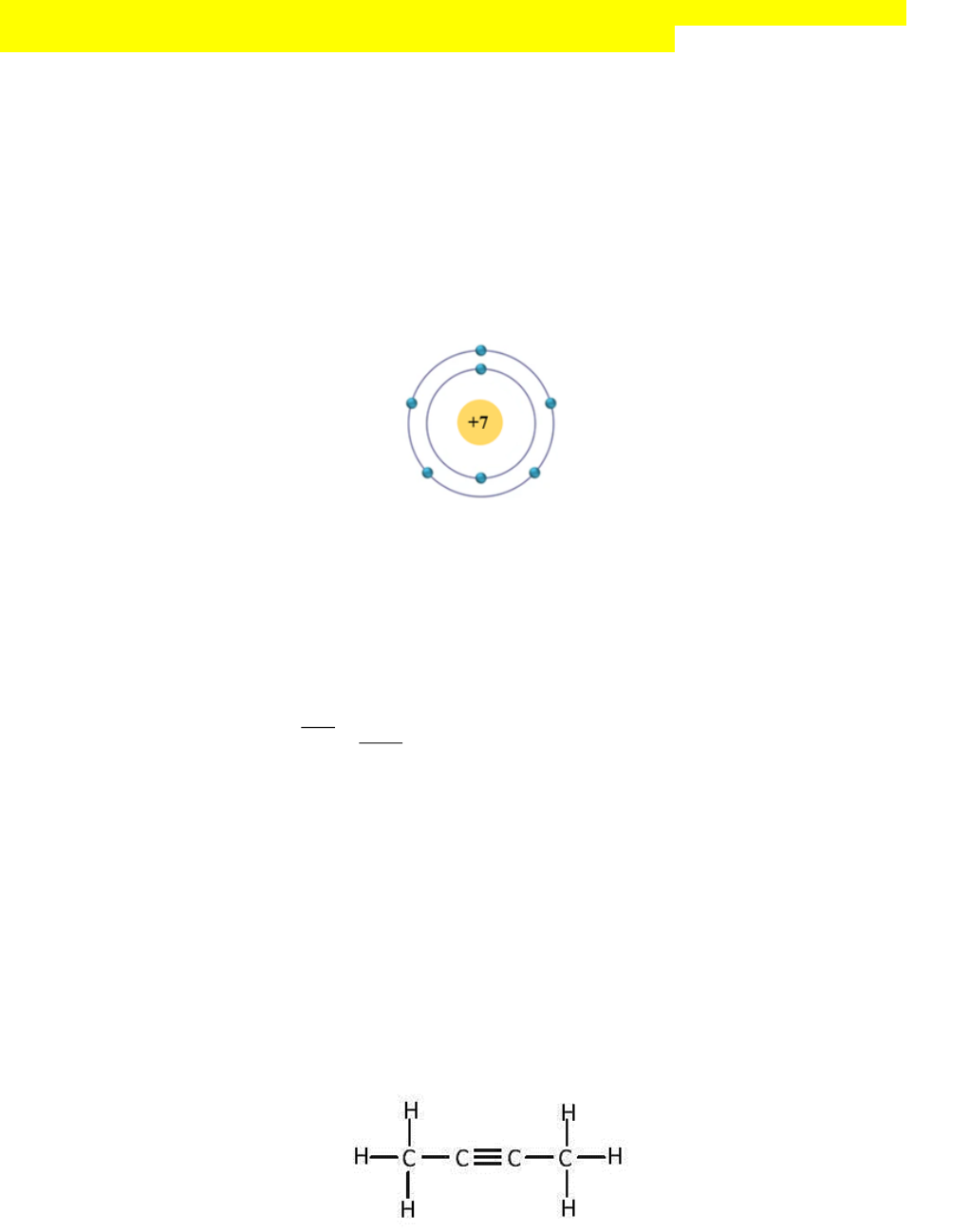
Câu 1. Nguyên tử nguyên tố nitrogen (hình dưới đây) chuyển thành ion mang điện tích là bao nhiêu khi
nhận electron để thỏa mãn quy tắc octet?
Mô hình cấu tạo nguyên tử nitrogen
Đáp án: -3.
Câu 2. Cho 0,99 gam hỗn hợp gồm potassium (K) và một kim loại kiềm X vào nước dư. Để trung hòa
dung dịch thu được cần 50 mL dung dịch HCl 1M. Nguyên tử khối của X là bao nhiêu? Cho nguyên tử
khối của các nguyên tố Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133.
Đáp án: 7.
2R + 2H
2
O 2ROH + H
2
ROH + HCl RCl + H
2
O
HCl ROH R R
0,99
n n n 0,05 mol M 19,8
0,05
M
Li
= 7 < 19,8 < M
K
= 39.
Câu 3. Cho các chất với trị số nhiệt độ sôi sau: (1) H
2
O, (2) H
2
S, (3) CH
4
và –161,58
o
C; –60,75
o
C;
100
o
C. Ghép giá trị nhiệt độ sôi vào mỗi chất sao cho tạo thành dãy ba chữ số theo thứ tự tăng dần nhiệt
độ sôi (ví dụ 123, 312,…)
Đáp án: 321.
Giá trị nhiệt độ sôi của từng chất: H
2
O (100
o
C); H
2
S (–60,75
o
C); CH
4
(–161,58
o
C).
Câu 4. Cho các ion: Li
+
, Ca
2+
, Al
3+
, F
-
, O
2-
, PO
4
3-
. Có bao nhiêu hợp chất ion (tạo nên từ một loại cation
và một loại anion) có thể được tạo thành từ các ion đã cho?
Đáp án: 9.
Công thức các hợp chất ion có thể tạo thành là: LiF, Li
2
O, Li
3
PO
4
, CaF
2
, CaO, Ca
3
(PO
4
)
2
, AlF
3
, Al
2
O
3
,
AlPO
4
.
Câu 5. Cho hợp chất hữu cơ X có công thức cấu tạo như sau:
Tổng số cặp electron dùng chung giữa các nguyên tử trong phân tử X là bao nhiêu?
Đáp án: 11.
Đề kiểm tra học kì 1 lớp 10 môn Hóa học có đáp án
VnDoc.com xin gửi tới bạn đọc bài viết Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 3 để bạn đọc cùng tham khảo và có thêm tài liệu ôn thi cuối học kì 1 lớp 10 sắp tới nhé. Đề thi được tổng hợp gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi trắc nghiệm đúng sai và 6 câu hỏi trắc nghiệm trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây.


