Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 5
Đề thi học kì 1 Hóa 10 KNTT
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí

ĐỀ 5
ĐỀ THI CUỐI HỌC KỲ I
NĂM HỌC ………
MÔN: HÓA 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
A. Proton. B. Electron. C. Proton và neutron. D. Neutron.
Câu 2. Các nguyên tử của cùng một nguyên tố hoá học là đồng vị của nhau có sự khác nhau về
A. số neutron. B. số proton. C. số electron. D. điện tích hạt nhân.
Câu 3. Kí hiệu phân lớp electron nào sau đây sai?
A. 3s. B. 3p. C. 3d. D. 3f.
Câu 4. Hình bên biểu diễn hình dạng orbital nguyên tử (AO) nào sau đây?
A. s. B. p
x
. C. p
y
. D. p
z
.
Câu 5. Cấu hình electron của nguyên tử Al (Z = 13) là
A.
2 2 6 3
1s 2s 2p 3p
. B.
2 2 5 2 2
1s 2s 2p 3s 3p
. C.
2 2 6 3
1 s 2 s 2p 2 d
. D.
2 2 6 2 1
1s 2s 2p 3s 3p
.
Câu 6. Phân tử nào sau đây có liên kết cộng hóa trị không phân cực?
A. HCl. B. N
2
. C. SO
2
. D. HBr.
Câu 7. Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17 . Cho các phát biểu sau:
(a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y.
(b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y.
(c) Trong các phản ứng hóa học, nguyên tử X có xu hướng nhường 2 electron.
(d) Khi hình thành liên kết với nguyên tử X, nguyên tử Y nhận 1 electron.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 8. Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
A. NH
3
. B. H
2
O. C. HF. D. CH
4
.
Câu 9. Lưu huỳnh (sulfur, S) thuộc nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học. Công thức
của sulfuric acid (tương ứng với oxide cao nhất của S) là
A. H
2
S. B. SO
3
. C. H
2
SO
3
. D. H
2
SO
4
.
Câu 10. Cho bảng số lượng electron, neutron và proton của các phần tử (nguyên tử hoặc ion) sau:
Phần tử
Số electron
Số neutron
Số proton
(a)
8
8
8
(b)
10
12
11
(c)
19
20
19
(d)
18
18
17
Những phần tử thuộc loại ion là
A. (a) và (d). B. (a) và (b). C. (c) và (d). D. (b) và (d).
Câu 11. Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn lần lượt là
A. 3 và 3. B. 4 và 3. C. 3 và 4. D. 4 và 4.
Câu 12. Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
A. IA. B. IIA. C. VIIIA. D. VIIA.
Câu 13. Trong phân tử carbon dioxide
O C O
số liên kết
và liên kết
lần lượt là
A. 0 và 4. B. 2 và 2 . C. 3 và 1 . D. 4 và 0 .
Câu 14. Trong một chu kì của bảng tuần hoàn các nguyên tố hóa học, theo chiều tăng dần điện tích hạt
nhân, bán kính nguyên tử của các nguyên tố giảm dần do số lớp electron ...(I), lực hút giữa hạt nhân với
electron lớp ngoài cùng ...(II). Cụm từ cần điền vào (I), (II) lần lượt là:
A. tăng dần, tăng dần. B. giảm dần, giảm dần.
C. không đổi, tăng dần. D. không đồi, giảm dần.
Câu 15. Cho các hình biểu diễn sự xen phủ orbital nguyên tử để tạo liên kết hóa học sau:
(a) Xen phủ trục s-s (b) Xen phủ trục s-p (c) Xen phủ trục p-p (d) Xen phủ bên p-p
Biết số hiệu các nguyên tử của H, F và
S
lần lượt là 1,9 và 16. Sự tạo liên kết trong các phân tử H
2
S và F
2
theo kiểu xen phủ tương ứng là
A. (a) và (c). B. (b) và (c). C. (b) và (d). D. (c) và (d).
Câu 16. Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
A. Công thức oxide cao nhất của
R
là
25
RO
.
B. R có tính phi kim mạnh hơn Si (Z = 14).
C. R là nguyên tố p.
D. Nguyên tử R có 5 electron ở phân lớp ngoài cùng.
Câu 17. Nguyên tố silicon Si thuộc chu kì 3, nhóm IVA trong bảng tuần hoàn các nguyên tố hoá học.
Công thức oxide cao nhất của silicon là
A.
2
SiO
. B.
SiO
. C.
23
H SiO
. D.
4
SiH
.
Câu 18. Cho bảng số liệu sau:
Chất
Nước (H
2
O)
Hydrogen sulfide (H
2
S)
Nhiệt độ sôi (
o
C) ở
1 atm
100,0
60,7
Phát biểu nào sau đây sai?
A. Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide.
B. Trong phân tử H
2
O và phân tử H
2
S chỉ có các liên kết cộng hóa trị.
C. Số liên kết trong phân tử H
2
O bằng số liên kết trong phân tử H
2
S.
D. Liên kết O – H trong phân tử H
2
O kém phân cực hơn liên kết S – H trong phân tử H
2
S.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
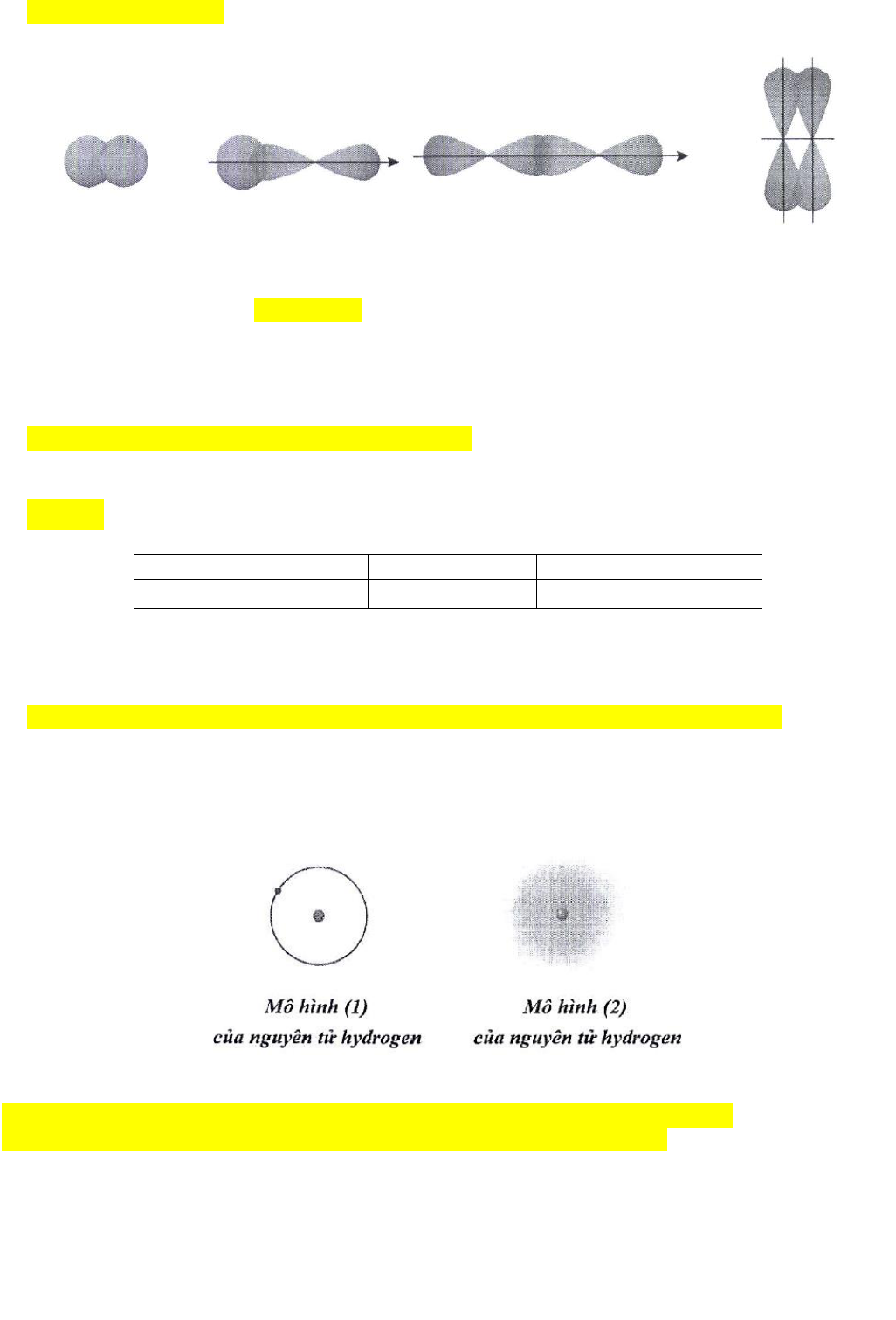
Câu 1. Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình
Rutherford - Bohr) và mô hình hiện đại của nguyên tử.
a. Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
b. Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
c. Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
d. Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Đáp án:
a. Sai. Mô hình (1) là mô hình hành tinh nguyên tử, mô hình (2) là mô hình hiện đại.
b. Sai. Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hiện đại của nguyên tử.
c. Đúng.
d. Đúng.
Câu 2. Natri (sodium,
11
Na) và magnesium (
12
Mg) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa
học.
a. Theo xu hướng biến đổi tính kim loại, Mg có tính kim loại yếu hơn Na.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt
động hóa học giữa Na và Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với Cl
2
, Na và Mg đều tạo ra hợp chất ion.
Đáp án:
a. Đúng.
b. Đúng.
c. Sai. Tính base của sodium hydroxide mạnh hơn tính base của magnesium hydroxide.
d. Đúng.
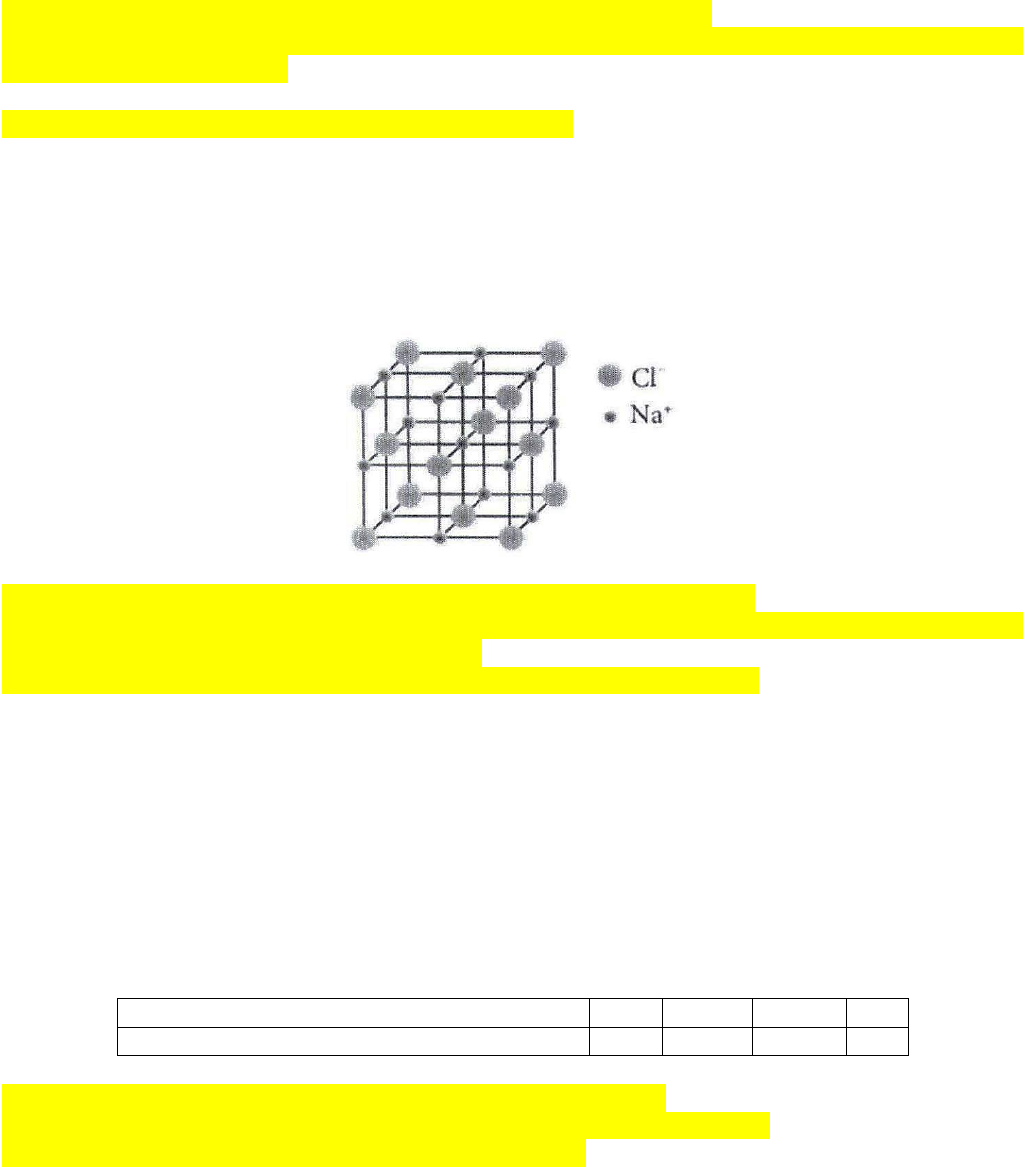
Câu 3. Khi đun nóng dung dịch sodium chloride bão hòa, thu được tinh thể sodium chloride khan. Sau
đó, nung nóng đến khoảng 800
o
C thì tinh thể sodium chloride chảy lỏng.
Cấu trúc tinh thể sodium chloride
a. Quá trình hình thành tinh thể sodium chloride ở trên được gọi là sự kết tinh.
b. Quá trình hình thành tinh thể sodium chloride ở trên là quá trình sắp xếp lại các ion Na
+
, Cl
–
từ chuyển
động tự do thành cấu trúc có trật tự trong tinh thể.
c. Trong tinh thể sodium chloride, xung quanh 1 ion Na
+
có 6 ion Cl
–
gần nhất.
d. Tinh thể sodium chloride nóng chảy ở khoảng 800
o
C, chứng tỏ lực liên kết giữa các ion trong tinh thể
là yếu.
Đáp án:
a. Đúng.
b. Đúng.
c. Đúng.
d. Sai. Tinh thể sodium chloride nóng chảy ở khoảng 8000C, chứng tỏ liên kết giữa các ion trong tinh thể
là rất mạnh.
Câu 4. Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học
gồm: F (Z = 9), Cl (Z = 17), Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tại dạng phân tử X
2
, giữa các
phân tử X
2
thường có tương tác với nhau. Cho giá trị năng lượng liên kết X – X ở bảng sau:
Liên kết
F – F
Cl – Cl
Br – Br
I – I
Năng lượng liên kết (kJ.mol
–1
) ở 25
o
C và 1 bar
159
243
193
151
Năng lượng liên kết X – X càng lớn thì liên kết càng bền.
a. Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns
2
np
5
.
b. Liên kết giữa các nguyên tử trong X
2
là liên kết cộng hoá trị không phân cực.
c. Tương tác giữa các phân tử X
2
là tương tác van der Waals.
d. Năng lượng liên kết Cl – Cl lớn nhất trong dãy trên vì Cl có bán kính nguyên tử nhỏ nhất.
Đáp án:
a. Đúng.
b. Đúng.
c. Đúng.
d. Sai. Hai nguyên tư
̉
halogen liên kê
́
t vơ
́
i nhau bă
̀
ng 1 liên kê
́
t σ. Tuy nhiên trong ca
́
c phân tư
̉
Cl
2
, Br
2
,
I
2
ngoa
̀
i liên kết σ co
̀
n co
́
thêm mô
̣
t phâ
̀
n liên kê
́
t π ta
̣
o nên bơ
̉
i sư
̣
che phu
̉
AO d trô
́
ng cu
̉
a nguyên tư
̉
halogen na
̀
y vơ
́
i AO p co
́
că
̣
p e cu
̉
a nguyên tư
̉
Halogen kia. Ma
̀
fluorine không co
́
kha
̉
năng ta
̣
o tha
̀
nh liên
kết π nên năng lươ
̣
ng liên kết cu
̉
a F-F < Cl-Cl. Tư
̀
Chlorine ⟶ Iodine năng lươ
̣
ng liên kết gia
̉
m dần do đô
̣
da
̀
i liên kết tăng dần.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Đề kiểm tra học kì 1 lớp 10 môn Hóa học có đáp án
Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 5 có đáp án được VnDoc.com tổng hợp và xin gửi tới bạn đọc cùng tham khảo. Đề thi được biên soạn theo cấu trúc đề thi tốt nghiệp THPT Quốc gia mới. Đề thi được tổng hợp gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi trắc nghiệm đúng sai và 6 câu hỏi trắc nghiệm trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây để có thêm tài liệu ôn thi cuối học kì 1 lớp 10 nhé.


