Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 1
Đề thi học kì 1 Hóa 10 KNTT
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí
ĐỀ 1
ĐỀ THI CUỐI HỌC KỲ I
NĂM HỌC ……..
MÔN: HÓA 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Đặc điểm của electron là
A. mang điện tích dương và có khối lượng. B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng. D. mang điện tích âm và không có khối lượng.
Câu 2. Các nguyên tố hoá học thuộc cùng một nhóm A có cùng số lượng
A. proton. B. electron hoá trị.
C. proton và neutron. D. proton và electron.
Câu 3. Cặp nguyên tử nào sau đây có cùng số neutron?
A.
11
5
B
và
12
6
C
. B.
7
3
Li
và
9
4
Be
. C.
24
12
Mg
và
24
18
Si
. D.
14
7
N
và
16
8
O
.
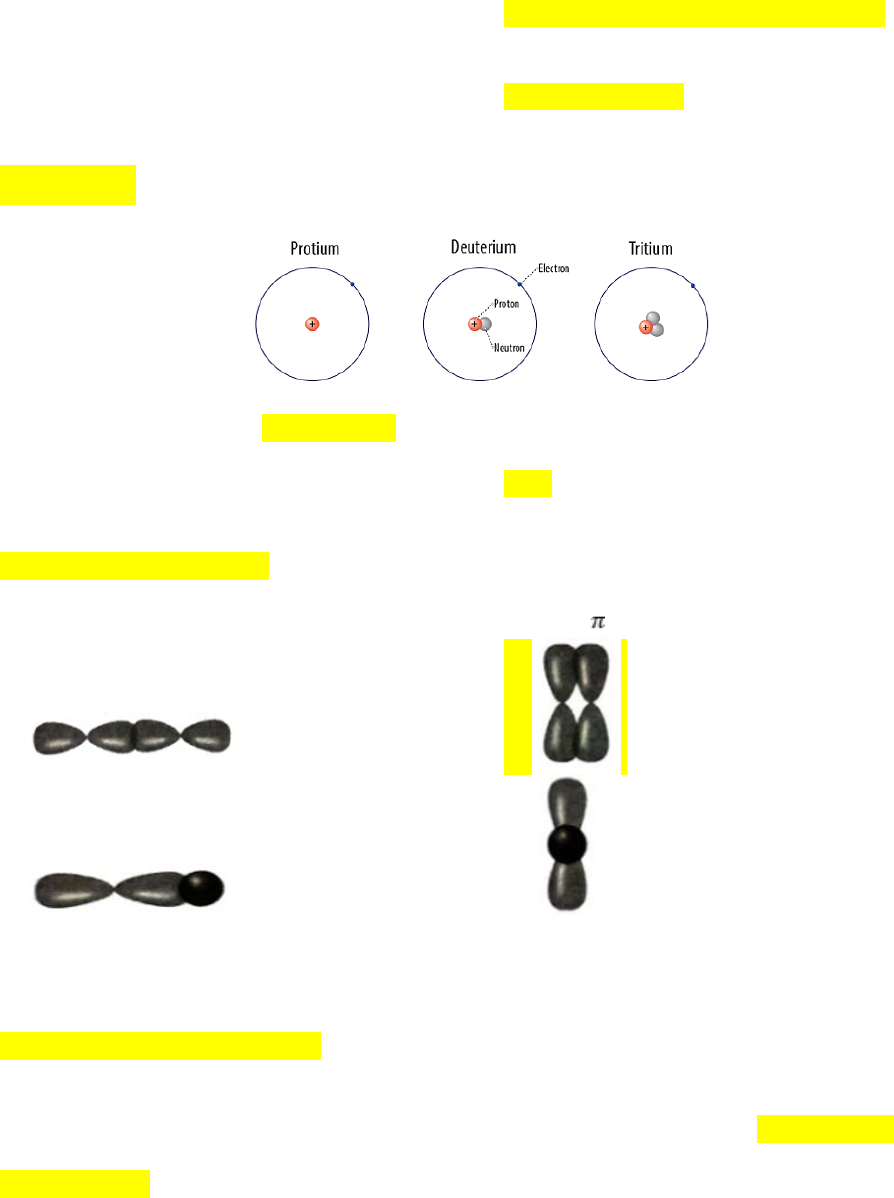
Câu 4. Hình ảnh mô hình nguyên tử các đồng vị của nguyên tử hydrogen được cho dưới đây:
Các đồng vị này khác nhau về
A. số proton. B. số neutron. C. số electron. D. số hiệu nguyên tử.
Câu 5. Lớp electron thứ 3 có bao nhiêu phân lớp electron?
A. 1. B. 2. C. 3. D. 4.
Câu 6. Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron trong ion
NH
4
+
là
A. 11 proton và 10 electron. B. 11 proton và 11 electron.
C. 10 proton và 11 electron. D. 10 proton và 10 electron.
Câu 7. Hình vẽ nào sau đây mô tả phù hợp sự tạo thành liên kết từ sự xen phủ các orbital nguyên tử?
A. . B. .
C. . D. .
Câu 8. Phát biểu nào sau đây về orbital nguyên tử là không đúng?
A. Mỗi orbital nguyên tử có thể chứa tối đa hai electron.
B. Orbital 1s, 2s và 4s đều có dạng hình cầu.
C. Có thể có các orbital khác ngoài orbital s, p.
D. Số orbital có trong lớp M là 8.
Câu 9. Một nguyên tố R có cấu hình electron: 1s
2
2s
2
2p
3
, công thức oxide cao nhất và hợp chất khí với
hydrogen và lần lượt là
A. R
2
O
5
, RH
5
. B. R
2
O
3
, RH. C. R
2
O
7
, RH. D. R
2
O
5
, RH
3
.
Câu 10. Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, độ âm điện có xu hướng
A. giảm xuống. B. tăng lên.
C. biến đổi không theo quy luật. D. không thay đổi.
Câu 11. Chromium được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng
bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3dd
5
4s
1
. Vị trí chromium trong bảng
tuần hoàn là

A. ố số 17, chu kì 4, nhóm IA.
B. ố số 24, chu kì 4, nhóm VIB.
C. ố số 24, chu kì 3, nhóm VB. D. ố số 27, chu kì 4, nhóm IB.
Câu 12. Liên kết cộng hóa trị không phân cực thường là liên kết giữa
A. hai kim loại giống nhau. B. hai phi kim giống nhau.
C. một kim loại mạnh và một phi kim mạnh. D. một kim loại yếu và một phi kim yếu.
Câu 13. Cation X
2+
(ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p
6
. Cấu hình electron của
nguyên tử X là
A. 1s
2
2s
2
2p
2
.
B. 1s
2
2s
2
2p
6
3s
2
.
C. 1s
2
2s
2
2p
4
.
D. 1s
2
2s
2
2p
5
.
Câu 14. Xét 3 nguyên tố có cấu hình electron lần lượt: X: 1s
2
2s
2
2p
6
3s
1
; Q: 1s
2
2s
2
2p
6
3s
2
;
Z:
1s
2
2s
2
2p
6
3s
2
3p
1
. Tính base tăng dần của các hydroxide là
A. XOH < Q(OH)
2
< Z(OH)
3
. B. Z(OH)
3
< XOH < Q(OH)
2
.
C. Z(OH)
3
< Q(OH)
2
< XOH. D. XOH < Z(OH)
3
< Q(OH)
2
.
Câu 15. Cho 2 nguyên tố: X (Z = 19) và Y (Z = 17). Công thức phân tử và bản chất liên kết của hợp chất
tạo bởi X và Y là
A. XY, liên kết ion. B. X
2
Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực. D. XY
2
, liên kết cộng hóa trị có cực.
Câu 16. Ở điều kiện thường, các khí hiếm tồn tại ở dạng khí đơn nguyên tử. Dựa vào nhiệt độ sôi của các
khí hiếm từ He đến Rn theo số liệu trong bảng sau:
Khí hiếm
He
Ne
Ar
Kr
Xn
Rn
Số hiệu nguyên tử
2
10
18
36
54
86
Nhiệt độ sôi (
0
C)
-269
-246
-186
-152
-108
-62
Hãy cho biết tương tác Van der Waals của khí hiếm nào mạnh nhất?
A. He. B. Rn. C. Ne. D. Xn.
Câu 17. Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử ?
A. Lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F; H – N , H – O ở phân tử này)
với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau.
C. Là lực hút tĩnh điện giữa các ion trái dấu.
D. Là lực hút giữa các nguyên tử trong một hợp chất cộng hóa trị.
Câu 18. Cho số hiệu nguyên tử của các nguyên tố H, C, N, O, Cl lần lượt là 1, 6, 7, 8, 17. Chất nào có
chứa liên kết ba?
A. Cl
2
. B. CH
4
. C. CO
2
. D. N
2
.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
Câu 1. Sulfur dạng kem bôi được sử dụng để điều trị mụn trứng cá. Nguyên tử sulfur có phân lớp electron
ngoài cùng là 3p
4
.
a. Hạt nhân nguyên tử sulfur có 16 electron.
b. Trong bảng tuần hoàn, sulfur nằm ở chu kì 3, nhóm IVA.
c. Oxide cao nhất của sulfur là SO
2
.
d. Độ âm điện của sulfur nhỏ hơn độ âm điện của phosphorus (Z = 15).
Đáp án:
Cấu hình của S là [Ne] 3s
2
3p
4
a. Sai. Hạt nhân không có hạt electron.
b. Sai. Nhóm VIA.
c. Sai. Oxide cao nhất của sulfur là SO
3
.
d. Sai. S có độ âm điện lớn hơn P trong cùng một chu kì.
Câu 2. Cho sơ đồ biểu diễn sự hình thành liên kết trong phân tử khí carbon dioxide (CO
2
) như sau:
a. Liên kết giữa nguyên tử O và C trong phân tử CO
2
là liên kết cộng hóa trị phân cực.

b. Phân tử CO
2
có 2 liên kết π và 2 liên kết σ.
c.
Phân tử CO
2
là phân tử phân cực.
d. Giữa nguyên tử C với mỗi nguyên tử O có 2 cặp electron chung.
Đáp án:
Công thức Lewis
a. Đúng.
b. Đúng.
c. Sai.
Phân tử CO
2
không phân cực do tổng momen lưỡng cực trong phân tử bằng không.
d. Đúng.
Câu 3. Mỗi phát biểu sau về tính chất chung của các hợp chất ion là đúng hay sai?
a. Khó nóng chảy, dễ bay hơi.
b. Tồn tại dạng tinh thể, tan nhiều trong nước.
c. Trong tinh thể chứa các ion, nếu hòa tan trong nước thì hỗn hợp dẫn được điện.
d. Đều tồn tại ở thể rắn ở điều kiện thường.
Đáp án:
a. Sai. Khó bay hơi.
b. Đúng.
c. Đúng.
d. Đúng.
Câu 4. Mô hình Rutherford – Bohr đã giải thích được rất nhiều các vấn đề trong khoa học nói chung và
hóa học nói riêng, đặc biệt là sự chuyển động của electron xung quanh hạt nhân.
a. Theo mô hình nguyên tử Rutherford – Bohr, khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
b. Electron chuyển động rất nhanh xung quanh hạt nhân và không theo quỹ đạo xác định.
c. Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử.
d. Mô hình Rutherford – Bohr nói về hình dạng và sự định hướng trong không gian của các orbital.
Đáp án:
a. Đúng.
b. Sai.
c. Đúng.
d. Sai. Mô hình hiện đại giải thích về hình dạng và sự định hướng trong không gian của các orbital.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Số hiệu nguyên tửcủa các nguyên tố X, A, M, Q, T lần lượt là 2, 7, 13, 19, 27. Trong số các
nguyên tố trên, có bao nhiêu nguyên tố là kim loại?
Đáp án: 3.
Câu 2. Nguyên tử oxygen (Z = 8) có xu hướng nhận bao nhiêu electron để đạt lớp vỏ thoả mãn quy tắc
octet?
Đáp án: 2.
Câu 3. Tổng số cặp electron dùng chung giữa các nguyên tử trong phân tử ethylene (C
2
H
4
) là bao nhiêu?
Đáp án: 6.
Câu 4. Cho các chất sau: NaCl, H
2
O, K
2
O, BaCl
2
, CaF
2
, HCl, NH
4
NO
3
. Trong các chất trên, có bao nhiêu
chất có liên kết ion?
Đáp án: 5.
Câu 5. Dưới đây là biểu đồ tương tác của hai nguyên tử hydrogen ở thể khí so với khoảng cách hạt nhân
giữa chúng:
Đề kiểm tra học kì 1 lớp 10 môn Hóa học có đáp án
Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề 1 có đáp án là tài liệu hữu ích giúp bạn đọc trau dồi, luyện tập nội dung kiến thức để chuẩn bị thật tốt cho kì thi cuối học kì 1 lớp 10 sắp tới nhé.
Đề thi được tổng hợp gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi trắc nghiệm đúng sai và 6 câu hỏi trắc nghiệm trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây.


