Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề 2
Đề thi học kì 1 Hóa 10 CTST
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Chân trời sáng tạo
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí
ĐỀ 2
ĐỀ THI HỌC KỲ I
MÔN: HÓA 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi
câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Hạt mang điện trong hạt nhân nguyên tử là:
A. Electron. B. Proton.
C. Neutron. D. Neutron và electron.
Câu 2. Cho các nguyên tử
12 14 14
6 7 6
X, Y, Z.
Những nguyên tử nào cùng thuộc một nguyên tố hóa
học?
A. X và Y. B. Y và Z. C. X và Z. D. X, Y và Z.
Câu 3. Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là
N
14
7
(99,63%) và
N
15
7
(0,37%).
Nguyên tử khối trung bình của nitrogen là:
A. 14,7. B. 14,0. C. 14,4. D. 13,7.
Câu 4. Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A.
↑↑
B.
↑
↑
↑
C.
↑↓
↑
D.
↑↑
↑
↑
Câu 5. Một nguyên tố R có cấu hình electron: 1s
2
2s
2
2p
6
3s
2
3p
4
, công thức hợp chất của R với
hydrogen và công thức oxide cao nhất là:
A. RH
2
, RO. B. RH
2
, RO
3
. C. RH
2
, RO
2
. D. RH
5
, R
2
O
5
.
Câu 6. Cấu hình electron nào sau đây không phải của kim loại?
A. 1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
. B. 1s
2
2s
2
2p
6
3s
2
3p
5
.
C. 1s
2
2s
2
2p
6
3s
2
. D. 1s
2
2s
2
2p
6
3s
2
3p
1
.
Câu 7. Ion nào sau đây không là ion đơn nguyên tử?
A. Al
3+
. B. NO
3
-
. C. Br
-
. D. Ca
2+
.
Câu 8. Sắp xếp tính base của NaOH, Mg(OH)
2
, Al(OH)
3
theo chiều giảm dần là:
A. NaOH, Mg(OH)
2
, Al(OH)
3
B. Al(OH)
3
, Mg(OH)
2
, NaOH
C. Mg(OH)
2
, Al(OH)
3
, NaOH
D. Mg(OH)
2,
NaOH, Al(OH)
3
Câu 9. Vị trí của nguyên tử nguyên tố X có Z= 20 trong bảng tuần hoàn là:

A. Chu kì 4, nhóm VIIB.
B. Chu kì 4, nhóm VIIIB.
C. Chu kì 4,nhóm IIA.
D. Chu kì 3, nhóm IIB.
Câu 10. Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân của nguyên tố Ca có 20 proton.
D. Nguyên tố Ca là một phi kim.
Câu 11. Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A
trong bảng tuần hoàn là:
A. Nhóm VA, chu kì 3.
B. Nhóm VIIA, chu kì 2.
C. Nhóm VIIB, chu kì 2 .
D. Nhóm VIA, chu kì 3.
Câu 12. Liên kết ion được tạo thành giữa?
A. Hai nguyên tử kim loại.
B. Hai nguyên tử phi kim.
C. Một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình.
D. Ba nguyên tử trở lên.
Câu 13. Nguyên tử của nguyên tố X có cấu hình electron 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
, nguyên tử của
nguyên tố Y có cấu hình electron 1s
2
2s
2
2p
5
. Liên kết hóa học giữa nguyên tử X và nguyên tử Y
thuộc loại liên kết nào?
A. Kim loại. B. Cộng hóa trị có cực. C. Ion. D. Cộng hóa trị không cực.
Câu 14. Công thức cấu tạo nào sau đây là công thức Lewis?
A. B. C. D.
Câu 15. Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
A. O
2
, H
2
O, NH
3
B. H
2
O, HCl, H
2
S
C. HCl, N
2
, H
2
S D. HCl, Cl
2
, H
2
O
Câu 16. Cho sơ đồ liên kết giữa các phân tử NH
3
:
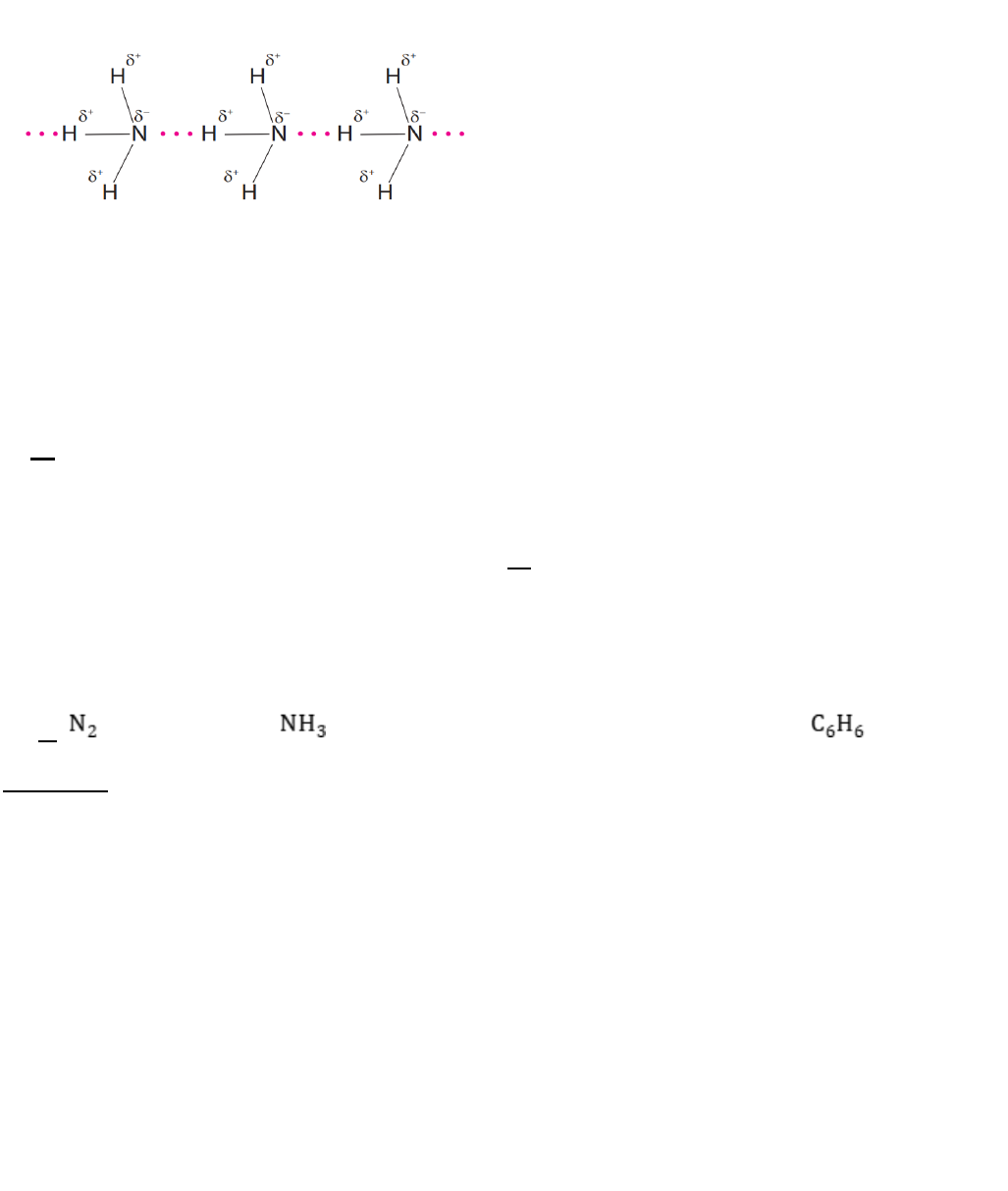
Trong sơ đồ trên, đường nét đứt( …) đại diện cho:
A. liên kết cộng hóa trị có cực.
B. liên kết ion.
C. liên kết cho – nhận.
D. liên kết hydrogen.
Câu 17. Cation M
2+
có cấu hình electron 1s
2
2s
2
2p
6
3s
2
3p
6
. Cấu hình electron của nguyên tử M là?
A. 1s
2
2s
2
2p
6
3s
2
B. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
C. 1s
2
2s
2
2p
6
3s
2
3p
4
D. 1s
2
2s
2
2p
6
3s
2
3p
2
Câu 18. . Phân tử nào sau đây có chứa liên kết ba?
A. B. C.H
2
O D.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d)
ở mỗi câu, thí sinh chọn đúng hoặc sai.(Đ – S)
Câu 1: Cấu hình electron của:
- Nguyên tử X: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
- Nguyên tử Y: 1s
2
2s
2
2p
6
3s
2
3p
4
a. Nguyên tử X chứa 19 electron.
b. Số hiệu nguyên tử của Y là Z
Y
= 16.
c. Trong nguyên tử X lớp electron ở mức năng lượng cao nhất là lớp M (n=3).
d. Nguyên tử Y có 4 e lớp ngoài cùng ⇒ Y là nguyên tố kim loại
Câu 2. Cho các phát biểu sau:
a. Các cặp nguyên tử
40
19
K
và
Ar
40
18
,
16
8
O
và
17
8
O
là đồng vị của nhau.
b. Mg có 3 đồng vị
24
Mg
,
25
Mg
,
26
Mg
; Cl có 2 đồng vị
35
Cl
,
37
Cl
. Vậy có 9 loại phân tử
MgCl
2
khác tạo nên từ các đồng vị của 2 nguyên tố đó.
Đề kiểm tra học kì 1 lớp 10 môn Hóa học có đáp án
Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề 2 có đáp án kèm theo là tài liệu hữu ích giúp bạn đọc có thể trau dồi, nội dung kiến thức, chuẩn bị thật tốt cho kì thi cuối học kì 1 lớp 10 nhé. Đề thi gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi đúng sai và 6 câu hỏi trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây.


