Đề thi học sinh giỏi môn Hóa lớp 9 THCS tỉnh Thanh Hóa năm 2015
Đề thi học sinh giỏi môn Hóa lớp 9
Đề thi học sinh giỏi môn Hóa lớp 9 THCS tỉnh Thanh Hóa năm 2015 là đề thi học sinh giỏi lớp 9 môn Hóa có kèm theo đáp án của tỉnh Thanh Hóa, là tài liệu bồi dưỡng học sinh giỏi môn Hóa hay, giúp các bạn học sinh tự ôn tập kiến thức, làm quen với dạng đề thi học sinh giỏi cũng như rèn luyện tư duy và cách trình bày khoa học. Mời các bạn tham khảo.
Đề thi học sinh giỏi môn Vật lý lớp 9 THCS tỉnh Thanh Hóa năm 2015
Đề thi học sinh giỏi môn Hóa học lớp 9 trường THCS Hào Phú, Tuyên Quang năm học 2016 - 2017
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO THANH HOÁ
|
KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH Năm học 2014 - 2015 Môn thi: Hóa Học Lớp 9 THCS Ngày thi: 25 tháng 03 năm 2015 Thời gian: 150 phút (không kể thời gian giao đề) Đề này có 10 câu, gồm 02 trang |
Câu 1: (2 điểm).
1. Viết các phương trình hóa học theo sơ đồ (mỗi mũi tên ứng với một phương trình)
![]()
2. Có 4 dung dịch riêng biệt cùng nồng độ 0,01M: H2SO4; CuSO4; NaOH; FeCl3. Trình bày phương pháp phân biệt các dung dịch trên.
Câu 2: (2 điểm).
1. Pha trộn m1(g) dung dịch chứa chất tan X nồng độ C1% với m2 (g) dung dịch cũng chứa chất tan X nồng độ C2%, thu được dung dịch có nồng độ C3%. Thiết lập biểu thức liên hệ giữa m1, m2, C1, C2, C3.
2. Khi cho 2 gam MgSO4 khan vào 200 gam dung dịch MgSO4 bão hòa ở to C đã làm cho m gam muối kết tinh lại. Nung m gam tinh thể muối kết tinh đó đến khối lượng không đổi, được 3,16 gam MgSO4 khan. Xác định công thức phân tử của tinh thể muối MgSO4 kết tinh (biết độ tan của MgSO4 ở toC là 35,1 gam).
Câu 3: (2 điểm).
1. Viết phương trình hóa học minh họa: Tính bazơ của NH3 yếu hơn NaOH; Tính axit của H2SO3 mạnh hơn H2CO3; Tính kim loại của Fe mạnh hơn Cu; Tính phi kim của clo mạnh hơn brom.
2. Có một mẫu vải chất liệu bằng sợi bông tự nhiên. Nhỏ vào mẫu vải vài giọt dung dịch H2SO4 đặc, tại vị trí tiếp xúc với axit vải bị đen rồi thủng. Nếu thay bằng dung dịch HCl đặc thì sau một thời gian, tại chỗ tiếp xúc với axit vải bị mủn dần rồi thủng. Viết phương trình hóa học để giải thích các hiện tượng trên.
Câu 4: (2 điểm).
Cho hỗn hợp gồm 2,4 gam Mg và 11,2 gam Fe vào 100 ml dung dịch CuSO4 2M. Sau phản ứng, thu được chất rắn A và dung dịch B. Cho dung dịch NaOH dư vào B, thu được kết tủa C. Nung C trong không khí đến khối lượng không đổi, thu được chất rắn D. Tính khối lượng các chất rắn A và D.
Câu 5: (2 điểm).
1. Giải thích tại sao khi bón phân urê cho cây trồng thì không nên bón cùng với vôi?
2. A là hợp chất của kali (88 < MA < 96). B là hợp chất của clo (MB < 38). Hòa tan m1 gam chất A vào nước, thu được dung dịch X có khả năng làm quì tím chuyển sang màu xanh. Hòa tan m2 gam chất B vào nước thu được dung dịch Y. Cho X tác dụng với Y, thu được dung dịch Z có khả năng hòa tan kẽm kim loại.
a) Xác định các hợp chất A, B và chất tan trong các dung dịch X, Y, Z.
b) Viết phương trình hóa học của các phản ứng xảy ra.
Câu 6: (2 điểm).
1. Nhiệt phân 22 gam C3H8 thu được hỗn hợp khí Y (gồm C3H8, CH4, C2H4, C3H6 và H2) có tỉ khối đối với hiđro bằng 13,75. Dẫn hỗn hợp Y qua dung dịch brom dư, thu được hỗn hợp khí Z có tỉ khối đối với hiđro bằng 12,2.
a) Tính hiệu suất nhiệt phân C3H8.
b) Tính thể tích khí oxi (đktc) tối thiểu cần dùng để đốt cháy hoàn toàn hỗn hợp Y.
c) Tính phần trăm thể tích mỗi chất trong Z.
2. Hợp chất hữu cơ A có công thức phân tử C6H6. Biết A làm mất màu dung dịch Br2. Hãy đề nghị một công thức cấu tạo phù hợp của A.
Câu 7: (2 điểm).
Nêu hiện tượng, giải thích bằng phương trình hóa học khi tiến hành các thí nghiệm sau:
a) Sục từ từ cho đến dư khí CO2 vào dung dịch nước vôi trong.
b) Nhỏ từ từ cho đến dư dung dịch KOH vào dung dịch AlCl3.
c) Nhỏ từ từ cho đến dư dung dịch AlCl3 vào dung dịch KOH.
d) Nhỏ từ từ cho đến dư dung dịch HCl vào dung dịch hỗn hợp NaOH và NaAlO2.
Câu 8: (2 điểm).
A là hỗn hợp hai oxit của hai kim loại. Cho CO dư đi qua 1,965 gam A nung nóng, sau phản ứng thu được chất rắn A1 và khí A2. Dẫn A2 qua dung dịch Ba(OH)2 dư, thu được 2,955 gam kết tủa. Cho A1 phản ứng với dung dịch H2SO4 10%, sau phản ứng (không có khí thoát ra), thu được dung dịch A3 chỉ chứa một chất tan có nồng độ 11,243% và còn lại 0,96 gam một chất rắn không phản ứng.
a) Xác định các chất trong A.
b) Xác định phần trăm khối lượng các chất trong A.
Câu 9: (2 điểm).
1. Khi làm khan ancol (rượu) etylic có lẫn một ít nước người ta dùng các cách sau:
a) Cho CaO mới nung vào rượu.
b) Cho Na2SO4 khan vào rượu.
Hãy giải thích?
2. Tính khối lượng glucozơ cần dùng trong quá trình lên men để tạo thành 5 lít ancol (rượu) etylic 46º (biết hiệu suất phản ứng là 90% và dC2H5OH =0,8 g/ml).
Câu 10: (2 điểm).
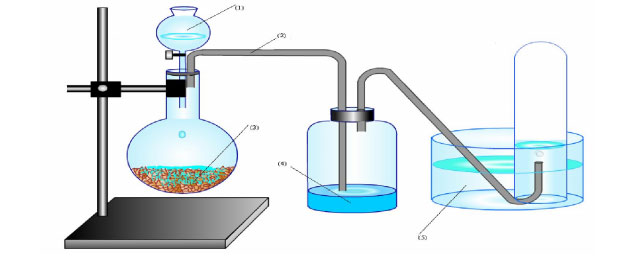
a) Hình trên mô tả sơ đồ điều chế và thu khí axetilen trong phòng thí nghiệm. Hãy cho biết các ghi chú từ (1) – (5) trên hình vẽ ghi những hóa chất gì.
b) Phương pháp thu khí axetilen trên là phương pháp gì? Vì sao lại thu như vậy?
Cho biết: H =1; C = 12; O = 16; Na = 23; Mg = 24; Al = 27; Cl = 35,5; K = 39; Fe = 56; Cu = 64; Ba = 137.
Chú ý:
- Thí sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học.
- Giám thị không giải thích gì thêm.
Đáp án đề thi học sinh giỏi tỉnh Thanh Hóa môn Hóa
| SỞ GIÁO DỤC VÀ ĐÀO TẠO THANH HÓA -------------------------------- ĐÁP ÁN CHÍNH THỨC (Đáp án gồm 3 trang) |
KÌ THI CHỌN HỌC SINH GIỎI CẤP TỈNH Năm học 2014-2015 Môn thi: Hóa học. Lớp 9.THCS Thời gian: 150 phút (không kể thời gian giao đề thi) |
Câu 1 (2 điểm).
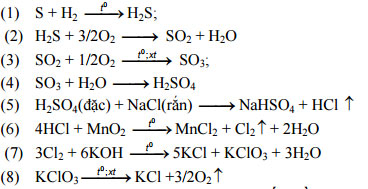
Chú ý: 0,25 đ/ 2 phương trình đúng. Thiếu điều kiện hoặc cân bằng sai trừ ½ số điểm của phương trình.
2.
| H2SO4 | CuSO4 | NaOH | FeCl3 | |
| Dung dịch NaOH | Kết tủa xanh | Kết tủa nâu đỏ | ||
| Quỳ tím | đỏ | xanh |
Nhận biết đúng mỗi chất được 0,25 điểm
Câu 2 (2 điểm)
1. Khối lượng chất tan trong dung dịch 1 = m1C1/100 (g)
Khối lượng chất tan trong dung dịch 2 = m2C2/100 (g).
mà (m3 = m1 + m2)
Khối lượng chất tan trong dung dịch 3 = (m1 + m2)C3/100 (g).
Áp dụng định luật bảo toàn khối lượng ta có: C3.(m1 + m2) = C1.m1 + C2.m2
2. Đặt công thức của muối là: MgSO4.nH2O
Khối lượng MgSO4 trong dung dịch ban đầu: 200.35,1/135,1 = 51,961 gam
Ở 20oC:
- 135,1 gam dung dịch có chứa 35,1 gam MgSO4
- (200+2 – m) gam dung dịch có chứa (51,961 + 2 – 3,16) gam MgSO4.
Từ đó tìm được m = 6,47 gam
Khi nung muối ta có:
MgSO4.nH2O → MgSO4 + nH2O (1)
Theo (1) ta được mH2O = 6,47 – 3,16 = 3,31 gam
=> 3,16/120.18n = 3,31 => n = 7
Vậy muối là: MgSO4.7H2O




