Đề thi học sinh giỏi môn Hóa học lớp 9 trường THCS Hào Phú, Tuyên Quang năm học 2016 - 2017
Đề thi học sinh giỏi môn Hóa học lớp 9
Đề thi học sinh giỏi môn Hóa học lớp 9 trường THCS Hào Phú, Tuyên Quang năm học 2016 – 2017. Đề thi gồm có 5 câu hỏi tự luận với thời gian làm bài là 150 phút. Phần đáp án cùng thang điểm chi tiết đã được chúng tôi cập nhật đầy đủ và chính xác. Mời các bạn cùng tham khảo.
Đề thi học sinh giỏi môn Hóa học lớp 9 năm học 2014 - 2015 huyện Thiệu Hóa, Thanh Hóa
Đề thi học sinh giỏi môn Hóa học lớp 9 huyện Phù Ninh, Phú Thọ năm 2015 - 2016
Đề thi học sinh giỏi môn Hóa học lớp 9 phòng GD&ĐT Nam Sách năm 2015 - 2016
| PHÒNG GD&ĐT SƠN DƯƠNG TRƯỜNG THCS HÀO PHÚ |
KỲ THI CHỌN HỌC SINH GIỎI LỚP 9 THCS NĂM HỌC 2016 - 2017 ĐỀ THI MÔN: HOÁ HỌC Thời gian: 150 phút (Không kể thời gian phát đề) |
Câu 1: (3,75 điểm)
Cho sơ đồ biến hóa sau:
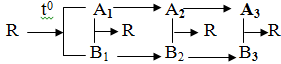
Tìm công thức của các chất A1, B1, A2, B2, A3, B3, R. Viết các phương trình phản ứng hóa học (ghi rõ điều kiện nếu có) thỏa mãn theo sơ đồ biến hóa trên.
Câu 2: (3,75 điểm)
Hỗn hợp A gồm Al2O3, MgO, Fe3O4, CuO. Cho khí CO dư qua A nung nóng tới phản ứng hoàn toàn được chất rắn B. Hoà tan B vào dung dịch NaOH dư được dung dịch C và chất rắn D. Cho dung dịch HCl dư vào dung dịch C và hoà tan chất rắn D vào dung dịch H2SO4 đặc nóng. Hãy xác định các chất có trong B, C, D và viết các phương trình phản ứng xảy ra.
Câu 3: (4,5 điểm)
Cho các lọ chứa các dung dịch (riêng biệt): NH4Cl; Zn(NO3)2; (NH4)2SO4; NaCl; phenolphtalein; Na2SO4; HCl bị mất nhãn. Chỉ dùng thêm dung dịch Ba(OH)2 làm thuốc thử có thể nhận biết được bao nhiêu chất trong số các chất đó cho? Viết các phương trình phản ứng hóa học minh họa.
Câu 4: (2,0 điểm)
Hòa tan hoàn toàn 10,2 gam một oxit kim loại hóa trị III cần 331,8 gam dung dịch H2SO4 vừa đủ. Dung dịch muối sau phản ứng có nồng độ 10%. Xác định công thức phân tử oxit kim loại?
Câu 5: (6,0 điểm)
Trộn CuO với một oxit kim loại hóa trị II theo tỉ lệ mol 1 : 2 được hỗn hợp A. Cho luồng H2 dư đi qua 2,4 gam A nung nóng thu được hợp B. Để hòa tan hết B cần 40 ml dung dịch HNO3 2,5M và thu được V lít NO duy nhất (đktc)
a) Xác định kim loại hóa trị II trên. Tính V?
b) Tính thành phần phần trăm khối lượng mỗi oxit trong hỗn hợp đầu. Biết hiệu xuất các phản ứng đạt 100%
(Cho biết H = 1; O = 16; Cu = 64; S = 32; N = 14)
ĐÁP ÁN ĐỀ THI HỌC SINH GIỎI MÔN HÓA LỚP 9
Câu 1
CaCO3 ![]() CaO + CO2
CaO + CO2
(R) (A1)
CaO + H2O → Ca(OH)2
(A2)
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
(A3)
2CO2 + Ba(OH)2 → Ba(HCO3)2
(B1) (B2)
2NaOH + Ba(HCO3) → BaCO3↓ + Na2CO3 + 2H2O
(B3)
CaO + CO2 → CaCO3
Ca(OH)2 + Ba(HCO3)2 → CaCO3 + BaCO3 + 2H2O
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Câu 2
- Cho CO qua A nung nóng
Fe3O4 + 4CO ![]() 3Fe + 4CO2
3Fe + 4CO2
CuO + CO ![]() Cu + CO2
Cu + CO2
=> Chất rắn B: Al2O3, MgO, Fe, Cu
- Chất rắn B + dung dịch NaOH dư
Al2O3 + 2NaOH → 2NaAlO2 + H2O
=> Dung dịch C: NaAlO2, NaOH dư
=> Chất rắn D: MgO, Fe, Cu
- Dung dịch C + dung dịch HCl dư
NaOH + HCl → NaCl + H2O
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
Al(OH)3 + 3HCl → AlCl3 + 3H2O
- Chất rắn D + dung dịch H2SO4 đặc
MgO + H2SO4 → MgSO4 + H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Câu 3
* Giai đoạn 1: Nhận được 5 chất (nhóm I)
- Dung dịch có màu hồng → phenolphtalein
- Chỉ có mùi khai → NH4Cl
2NH4Cl + Ba(OH)2 → 2NH3 + BaCl2 + 2H2O
- Có mùi khai và ↓ trắng => (NH4)2SO4
(NH4)2SO4 + Ba(OH)2→ 2NH3 + BaSO4 + 2H2O
- Chỉ có ↓ trắng => Na2SO4
2Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
- Có ↓, sau đó ↓ tan => Zn(NO3)2
Zn(NO3)2 + Ba(OH)2 → Ba(NO3)2 + Zn(OH)2
Zn(OH)2 + Ba(OH)2 → Ba[Zn(OH)4] (hoặc BaZnO2 + H2O)
* Giai đoạn 2 (nhận được 2 chất còn lại) dd HCl và NaCl (nhóm II) Lấy một ít dd (Ba(OH)2 có chứa phênolphtalein có màu hồng cho vào 2 ống nghiệm. Cho từ từ lần lượt từng giọt mỗi chất ở nhóm II vào hai ống nghiệm:
- dd nào làm mất màu hồng trong ống nghiệm sau một thời gian dd HCl
HCl + Ba(OH)2 -> BaCl2 + H2O (PU trung hòa)
- Còn lại là dd NaCl
Câu 4
Gọi CTPT oxit R2O3
Ta có PTPU: R2O3 + 3H2SO4 → R2(SO4)3 + 3H2O
Khối lượng muối trong dung dịch sau pư:
![]()
Lập phương trình toán học
![]()
=> R = 27 (Al) => CTPT oxit: Al2O3
Câu 5
Gọi oxit kim loại hóa trị II là MO
Gọi b và 2b lần lượt là số mol CuO và MO đã dùng. Vì H2 chỉ khử những kim loại đứng sau nhôm trong dãy điện hóa nên có 2 khả năng xảy ra:
* TH1: M đứng sau nhôm trong dãy điện hóa => MO phản ứng được với H2
* PTPU:
CuO + H2 ![]() Cu + H2O
Cu + H2O
b b
MO + H2 ![]() M + H2O
M + H2O
2b 2b
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
b 8b/3
3M + 8HNO3 → 3M(NO3)2 + 2NO + H2O
2b 16b/3
Ta có hệ PT: 80b + (M + 16)2b = 2,4
8b/3 + 16b/3 = 0,04.2,5 = 0,1
Giải PT ta được b = 0,0125 và M = 40 (Ca)
Nhưng Ca đứng trước Al tong dãy điện hóa (loại) => xảy ra trường hợp 2
* TH2: M đứng trước nhôm trong dãy điện hóa => MO không phản ứng được với H2
* PTPU:
CuO + H2 ![]() Cu + H2O
Cu + H2O
b b
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
b 8b/3 2b/3
MO + 2HNO3 → M(NO3)2 + H2O
2b 4b
Ta có hệ PT: 80b + (M + 16)2b = 2,4
8b/3 + 4b = 0,04.2,5 = 0,1
Giải PT ta được b = 0,015 và M = 24 (Mg)
* Tính V NO = 2b/3 x 22,4 = 0,224 (lit)
%CuO = 80.0,015/2,4 = 50%
%MgO = 100 - 50 = 50%




