Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường Chuyên Lê Hồng Phong, Nam Định



Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường Chuyên Lê Hồng Phong, Nam Định được VnDoc tổng hợp, biên soạn kèm đáp án, hướng dẫn lời giải chi tiết. Đề thi gồm 40 câu hỏi trắc nghiệm nằm trong bài thi phân môn Khoa học tự nhiên môn thi Hóa học, nội dung đề thi đảm bảo bám sát cấu trúc đề thi thử của bộ GD&ĐT đưa ra trước đó.
Hy vọng với Đề thi thử THPT Quốc gia 2020 môn Hóa của các trường đưa ra sẽ giúp các em ôn luyện đề tốt hơn, chuẩn bị cho kì thi THPT quốc gia môn Hóa học.
Để xem chi tiết đề thi cũng như hướng dẫn giải chi tiết xin vui lòng ấn tải link phía dưới
Đề thi thử THPT Quốc gia 2020 môn Hóa
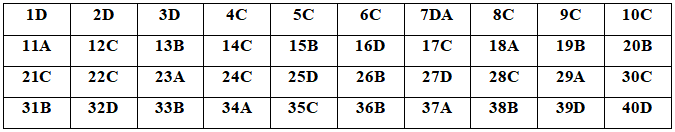
1. Đáp án Đề thi thử THPT Quốc gia 2020 môn Hóa Chuyên Lê Hồng Phong, Nam Định
2. Hướng dẫn giải Đề thi thử THPT Quốc gia 2020 môn Hóa Chuyên Lê Hồng Phong, Nam Định
Câu 10. Kim loại nào sau đây tan hoàn toàn trong dung dịch H2SO4 đặc, nguội dư?
A. Au.
B. Fe.
C. Cu.
D. Al.
Hướng dẫn giải
Câu 11. Phenol (C6H5OH) không tác dụng với hóa chất nào sau đây?
A. NaHCO3.
B. NaOH.
C. Br2 trong nước.
D. Na.
Hướng dẫn giải
Câu 16. Thuốc thử để phân biệt Fe2O3 và Fe3O4 là
A. dung dịch CuSO4.
B. dung dịch NaOH.
C. dung dịch HCl.
D. dung dịch HNO3.
Hướng dẫn giải
Sử dụng dung dịch HNO3. Chất nào có khí thoát ra là Fe3O4 hất còn lại phản ứng không có khí thoát ra là Fe2O3.
Câu 21. Hỗn hợp X gồm hai chất có tỉ lệ mol 1 : 1. Cho X tác dụng với dung dịch H2SO4 loãng (vừa đủ), thu được dung dịch có chứa hai muối sắt có số mol bằng nhau. Hỗn hợp X là
A. FeO và Fe3O4.
B. Fe2O3 và Fe3O4.
C. Fe2O3 và FeO.
D. FeO và Fe.
Hướng dẫn giải
Fe3O4 = Fe2O3 + FeO. Vậy để thu được 2 muối sắt có số mol bằng nhau thì hỗn hợp phải chứa FeO và Fe2O3
Câu 22. Cho 13 gam bột Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Sau phản ứng hoàn toàn, thu được chất rắn có khối lượng là
A. 12,8.
B. 23,6.
C. 20,4.
D. 17,2.
Hướng dẫn giải
nZn = 0,2 mol. Dung dịch sau phản ứng: Zn2+ = 0,2 mol; NO3- = 0,5 mol => Cu2+ = 0,05 mol
Chất rắn gồm Ag = 0,1 mol, Cu = 0,2 - 0,05 = 0,15 mol => mchất rắn = 20,4 gam
Câu 24. Chất X và Y có công thức phân tử C4H9O2N. Cho X tác dụng với dung dịch NaOH, thu được sản phẩm hữu cơ gồm X1 (C2H4O2NNa) và chất X2. Cho chất Y tác dụng với NaOH, thu được sản phẩm hữu cơ gồm Y1 (C3H3O2Na) và chất Y2. Công thức của X2 và Y2 lần lượt là
A. C2H5OH và C2H5NH2.
B. CH3OH và C2H5NH2.
C. C2H5OH và CH3NH2.
D. CH3OH và CH3NH2.
Hướng dẫn giải
Câu 27. Thủy phân m gam saccarozơ trong môi trường axit rồi cho toàn bộ sản phẩm tác dụng với AgNO3 dư trong dung dịch NH3, thu được 21,6 gam Ag. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 34,2.
B. 22,8.
C. 11,4.
D. 17,1.
Hướng dẫn giải
Saccarozơ + H2O → glucozơ + fructozơ → 4Ag
nAg = 0, 2 =>nSac = 0, 05 => m =17,1gam
Câu 28. Trung hòa dung dịch chứa 5,9 gam amin X no, đơn chức, mạch hở bằng dung dịch HCl, thu được 9,55 gam muối. Số công thức cấu tạo của X là
A. 2.
B. 1.
C. 4.
D. 3.
Hướng dẫn giải
nX = nHCl = (mmuối – mX)/36,5 = 0,1 mol
=> MX = 59(C3H9N)
CTCT: CH3CH2CH2NH2; CH3CH(NH2)CH3; CH3NHCH2CH3; (CH3)3N
Câu 29. Cho các thí nghiệm sau:
(a) Nung hỗn hợp Al và Fe2O3 (tỉ lệ mol 2 : 1) ở nhiệt độ cao.
(b) Cho khí NH3 vào dung dịch FeCl3.
(c) Nung Cu(NO3)2 ở nhiệt độ cao.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
Số thí nghiệm sau khi các phản ứng xảy ra hoàn toàn, thu được đơn chất trong sản phẩm là
A. 2.
B. 3.
C. 1.
D. 4.
Hướng dẫn giải
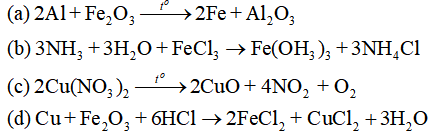
Câu 30. Hỗn hợp E gồm kim loại kiềm X và kim loại kiềm thổ Y thuộc cùng chu kì. Cho 11,8 gam E tan hoàn toàn trong dung dịch HCl dư, thu được 4,48 lít khí hiđro (đktc). Kim loại X và Y tương ứng là
A. Li và Be.
B. Na và Mg.
C. K và Ca.
D. Rb và Sr.
Hướng dẫn giải
Gọi kim loại chung là M, hóa trị x
Ít nhất 1 trong 2 kim loại phải có phân tử khối thuộc khoảng này. Chọn K và Ca
Câu 32. Cho m gam hỗn hợp X gồm các triglixerit tác dụng với dung dịch KOH vừa đủ, thu được glixerol và a gam hỗn hợp muối của axit oleic và axit stearic. Hiđro hóa m gam X cần dùng 0,02 mol H2 (xúc tác Ni, t°), thu được triglixerit Y. Đốt cháy hoàn toàn Y, thu được số mol CO2 nhiều hơn số mol H2O là 0,08 mol. Giá trị của a là
A. 36,68.
B. 38,20.
C. 36,24.
D. 38,60.
Hướng dẫn giải
Y no và có K = 3 nên nX = nY = 0,08/2 = 0,04 => n tổng muối = 3nx = 0,12 mol
Câu 33. Hỗn hợp E gồm ba este no, đơn chức mạch hở X, Y, Z và đều có phân tử khối nhỏ hơn 88. Thủy phân hoàn toàn 0,1 mol E trong dung dịch NaOH đun nóng, thu được m gam muối. Giá trị của m là
A. 8,6.
B. 7,4.
C. 6,8.
D. 8,2.
Hướng dẫn giải
E gồm: HCOOCH3; HCOOC2H5; CH3COOCH3
Muối gồm HCOONa và CH3COONa có tổng số mol là 0,1 mol
=> 68.0,1 < mmuối < 82.0,1 => chọn mmuối = 7,4
Câu 34. Đốt cháy hoàn toàn 13,02 gam P trong khí oxi dư, sau đó cho sản phẩm phản ứng đó tác dụng với V lít dung dịch chứa NaOH 1M và Na3PO4 1M, thu được dung dịch X chứa hai muối NaH2PO4 và Na2HPO4 có tỉ lệ mol 1 : 2. Giá trị của V là
A. 0,30.
B. 0,35.
C. 0,20.
D. 0,25.
Hướng dẫn giải
Câu 35. Điện phân (với điện cực trơ) dung dịch chứa 0,2 mol Cu(NO3)2, sau khi khối lượng dung dịch điện phân giảm 10 gam thì dừng điện phân và thu được dung dịch X. Thêm tiếp m gam bột sắt vào X, thu được khí NO (sản phẩm khử duy nhất của NO3-) và 0,7m gam chất rắn gồm hai kim loại. Giá trị của m là
A. 16,8.
B. 13,5.
C. 15,5.
D. 14,0.
Hướng dẫn giải
Chất rắn 0,7m gam chứa 2 kim loại nên Cu2+ còn dư
.............................
Ngoài ra các bạn có thể tham khảo thêm một số đề thi thử năm 2020 môn Hóa học mới nhất của các Sở, Trường THPT trên cả nước dưới đây
- Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thanh Hóa
- Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường THPT Pleiku, Gia Lai
VnDoc.com xin gửi tới bạn đọc bài viết Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường Chuyên Lê Hồng Phong, Nam Định để bạn đọc cùng tham khảo. Đề thi gồm có 40 câu hỏi trắc nghiệm khách quan, thí sinh làm bài trong thời gian 50 phút. Đề thi này được đánh giá khá hay phù hợp đánh giá phân loại học lực. Mời các bạn cùng tham khảo.
Trên đây VnDoc.com vừa giới thiệu tới các bạn Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường Chuyên Lê Hồng Phong, Nam Định, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa lớp 12. Mời các bạn cùng tham khảo thêm các môn Ngữ văn 12, Tiếng Anh 12, Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Vật Lý,....
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Quyết tâm đỗ Đại Học Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.

