Giải Sách bài tập Hóa học 9 bài 44
Giải Sách bài tập Hóa học 9 bài 44: Rượu etylic
Giải Sách bài tập Hóa học 9 bài 44: Rượu etylic được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi trong sách bài tập nằm trong chương trình giảng dạy môn Hóa học 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây
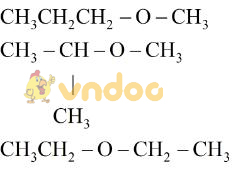
Bài 44.1 trang 53 Sách bài tập Hóa học 9: A, B, C là ba hợp chất hữu cơ có công thức phân tử tương ứng là C2H60, C3H80, C4H10O. Hãy viết công thức cấu tạo của A, B, C biết cả ba chất đều tác dụng được với natri giải phóng hiđro.
Lời giải:
A, B, C tác dụng được với Na giải phóng hiđro. Vậy A, B, C có nhóm -OH trong phân tử.
Với C2H60 có 1 công thức cấu tạo.
Với C3H80 có 2 công thức cấu tạo.
Với C4H80 có 4 công thức cấu tạo.
Bài 44.2 trang 53 Sách bài tập Hóa học 9: Nhận định nào sau đây đúng?
A. Rượu 45° khi sôi có nhiệt độ không thay đổi.
B. Trong 100 gam rượu 45°, có 45 gam rượu và 55 gam H20.
C. Natri có khả năng đẩy được tất cả các nguyên tử hiđro ra khỏi phân tử rượu etylic.
D. Trong rượu etylic, natri chỉ đẩy được nguyên tử hiđro trong nhóm -OH.
Lời giải:
Đáp án D.
Bài 44.3 trang 53 Sách bài tập Hóa học 9: Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
a) Cho natri vào hỗn hợp rượu etylic và benzen.
b) Cho natri vào rượu 45°.
Lời giải:
Các phương trình hoá học.
a) 2Na + 2C2H5OH → 2C2H5ONa + H2 ↑
Na + C6H6 → không phản ứng.
b) Na phản ứng với H2O trước:
2Na + 2H20 → 2NaOH + H2 ↑
Sau đó Na sẽ phản ứng với rượu:
2Na + 2C2H5OH → 2C2H5ONa + H2 ↑
Bài 44.4 trang 53 Sách bài tập Hóa học 9: Rượu etylic tan nhiều trong nước vì trong phân tử có
A. Hai nguyên tử cacbon.
B. Sáu nguyên tử hiđro.
C. Nhóm -OH.
D. Hai nguyên tử cacbon và sáu nguyên tử hiđro.
Lời giải:
Đáp án C.
Bài 44.5 trang 53 Sách bài tập Hóa học 9: Đốt cháy hoàn toàn 3 gam chất hữu cơ A chứa các nguyên tố C, H, O thu được 6,6 gam khí CO2 và 3,6 gam H20.
a) Hãy xác định công thức phân tử của A, biết khối lượng mol phân tử của A là 60 gam/mol.
b) Viết công thức cấu tạo có thể có của A, biết phân tử A có nhóm -OH.
c) Viết phương trình hoá học của phản ứng giữa A với Na.
Lời giải:
a) Gọi công thức của A là CxHyOz.
Đốt cháy 3 gam A được 6,6 gam CO2 và 3,6 gam H20.
Vậy mC trong 3 gam A là 6,6/44 x 12 = 1,8g
mH trong 3 gam A là 3,6/18 x 2 = 0,4g
Vậy trong 3 gam A có 3 - 1,8 - 0,4 = 0,8 (gam) oxi.
Ta có quan hệ:
60 gam A → 12x gam C → y gam H → 16z gam O
3 gam A → 1,8 gam C → 0,4 gam H → 0,8 gam O
=> x = 60 x 1,8 /36 = 3; y = 60 x 0,4/3 = 8
z = 60 x 0,8/48 = 1
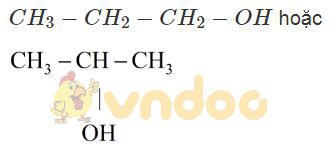
Công thức của A là C3H80.
b) Công thức cấu tạo của A có thể là:
c) Phương trình hoá học của phản ứng giữa A với Na :
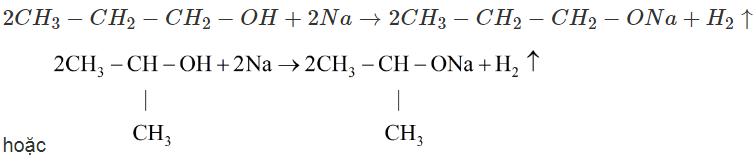
Bài 44.6 trang 54 Sách bài tập Hóa học 9: Hỗn hợp X gồm rượu etylic và một rượu A có công thức CnH2n+1OH.
Cho 1,52 gam X tác dụng hết với Na thấy thoát ra 0,336 lít H2 (đktc). Biết tỉ lệ số mol của rượu etylic và rượu A trong hỗn hợp là 2 : 1.
a) Xác định công thức phân tử của rượu A.
b) Tính thành phần phần trăm khối lượng của mỗi rượu trong X.
c) Viết công thức cấu tạo của X.
Lời giải:
a) Phương trình hoá học của phản ứng giữa X với Na
(1) 2C2H5OH + 2Na → 2C2H5ONa + H2 ↑
(2) 2CnH2n+1OH + 2Na → 2CnH2n+1ONa + H2 ↑
Đặt số mol rượu etylic trong hồn hợp là 2x.
Theo đề bài: số mol rượu CnH2n+1OH là x.
Theo phương trình (1), (2) ta có:
Số mol H2 = x + x/2 = 3x/2
Theo đề bài số mol H2 = 0,336/22,4 = 0,015 mol
→ 3x/2 = 0,015 → x= 0,01 mol
Vậy: ![]() \(m_{C_2H_5OH}\) = 2x x 46 = 2 x 0,01 x 46 = 0,92g
\(m_{C_2H_5OH}\) = 2x x 46 = 2 x 0,01 x 46 = 0,92g
→ ![]() \(m_{C_nH_{2n}}\) + 1OH = 1,52 - 0,92 = 0,6
\(m_{C_nH_{2n}}\) + 1OH = 1,52 - 0,92 = 0,6
Ta có: x(14n + 1 + 17) = 0,6.
Hay 0,01(14n + 18) = 0,6 => n = 3.
Rượu A có công thức C3H7OH.
b) Phần trăm khối lượng của C2H5OH: 0,92/1,52 x 100% = 60,53%
Phần trăm khối lượng của C3H7OH: 100% - 60,53% = 39,47%.
Bài 44.7 trang 54 Sách bài tập Hóa học 9: Hai chất hữu cơ A, B có cùng công thức phân tử. Đốt cháy hoàn toàn 7,4 gam hỗn hợp A, B thu được 17,6 gam CO2 và 9 gam H20. Xác định công thức phân tử của A, B. Biết trong phân tử A, B chứa một nguyên tử oxi.
Cho 7,4 gam hỗn hợp A, B tác dụng với Na dư sao cho phản ứng xảy ra hoàn toàn thấy tạo ra 0,672 lít khí H2 ở đktc. Hãy xác định công thức cấu tạo của A, B.
Lời giải:
Gọi công thức phân tử của A, B là CxHyO
Phương trình hoá học:
CxHyO + (x +y/4 -1/2)O2 → xCO2 + y/2 H2O
![]() \(n_{CO_2}\) = 17,6/44 = 0,4 mol;
\(n_{CO_2}\) = 17,6/44 = 0,4 mol; ![]() \(n_{H_2O}\) = 9/18 = 0,5 mol (1)
\(n_{H_2O}\) = 9/18 = 0,5 mol (1)
mC = 0,4.12 = 4,8 gam; mH = 0,5.2 = 1g (2)
Từ (1), (2)
→ x : y : 1 = 4,8/12 : 1/1 : 1,6/16 = 0,4 : 1 : 0,1
Vậy mO = 7,4 - 4,8 - 1,0 = 1,6 (gam)
=> Công thức phân tử của A, B là C4H10O.
Ta có MA,B = 74 (g/mol)
nA,B = 7,4/74 = 0,1 mol
Khi phản ứng với Na có khí bay ra → trong A, B có nhóm OH.
Phương trình hoá học:
C4H9OH + Na → C4H9ONa + 1/2H2
Vậy số mol có nhóm OH là 2![]() \(n_{H_2}\) = 2. 0,672/22,4 = 0,06 < nA,B
\(n_{H_2}\) = 2. 0,672/22,4 = 0,06 < nA,B
→ trong A, B có 1 chất không có nhóm OH → Cấu tạo tương ứng là
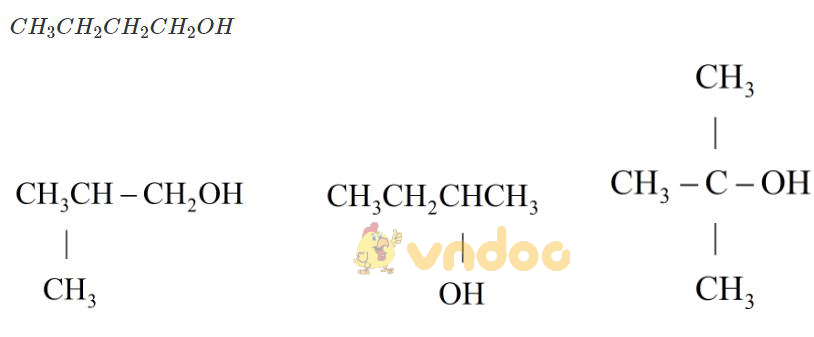
Chất không có nhóm OH: