Giải Sách bài tập Hóa học 9 bài 42
Giải Sách bài tập Hóa học 9 bài 42: Luyện tập chương 4: Hiđrocacbon - Nhiên liệu
Giải Sách bài tập Hóa học 9 bài 42: Luyện tập chương 4: Hiđrocacbon - Nhiên liệu được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi trong sách bài tập nằm trong chương trình giảng dạy môn Hóa học 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây
Bài 42.1 trang 51 Sách bài tập Hóa học 9: Viết các phương trình hoá học của phản ứng đốt cháy các chất sau: CnH2n+2, CmH2m, CaH2a-2
Lời giải:
Các phương trình phản ứng cháy của các chất:
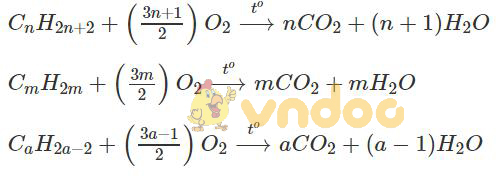
Bài 42.2 trang 52 Sách bài tập Hóa học 9: Nêu phương pháp phân biệt các bình đựng riêng biệt các chất khí sau:
a) CH4; C2H2; SO2.
b) C2H6; C2H4; H2.
Lời giải:
a) Thí nghiệm 1: Dẫn các khí qua ống thuỷ tinh vuốt nhọn rồi đốt. Hai khí cháy được là CH4 và C2H2. Khí không cháy được là SO2.
Thí nghiệm 2: Dẫn hai khí “cháy được” qua dung dịch brom Khí nào làm mất màu dung dịch brom, đó là C2H2, khí còn lại là CH4.
b) Dùng dung dịch brom nhận được C2H4. Đốt cháy hai chất còn lại và cho sản phẩm hấp thụ vào nước vôi trong nhận được C2H6, còn lại là H2.
Bài 42.3 trang 52 Sách bài tập Hóa học 9: A, B, C là ba hiđrocacbon khi đốt cháy đều thu được số mol khí CO2 bằng hai lần số mol hiđrocacbon đem đốt. Biết:
A Không làm mất màu dung dịch brom.
Một mol B tác dụng được tối đa với 1 mol brom.
Một mol C tác dụng được tối đa với 2 mol brom.
Hãy xác định công thức phân tử và công thức cấu tạo của A, B, C.
Lời giải:
Gọi công thức của ba hiđrocacbon đó là: CxHy, CaHb, CnHm.
Khi đốt ta có:
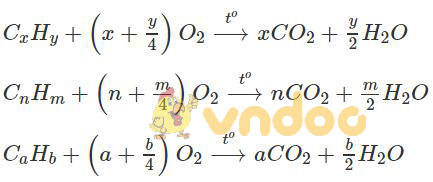
Vì số mol CO2 tạo ra bằng 2 lần số mol hiđrocacbon đem đốt. Vậy theo phương trình hoá học của phản ứng cháy
→ X = a = n = 2.
Mặt khác: A không làm mất màu nước brom → không có liên kết đôi hoặc ba. Vậy A là CH3 - CH3.
1 mol B chỉ tác dụng tối đa với 1 mol brom → có 1 liên kết đôi.
Vậy B là CH2 = CH2.
1 mol C tác dụng tối đa với 2 mol brom → có liên kết ba.
Vậy C là CH ≡CH.
Bài 42.4 trang 52 Sách bài tập Hóa học 9: Hiđrocacbon X có công thức phân tử là C4H10
a) Viết các công thức cấu tạo của X.
b) Biết X có phản ứng thế với clo (clo thế hiđro ở vị trí bất kì) khi có ánh sáng. Hãy viết phương trình hoá học của phản ứng xảy ra khi cho X tác dụng với Cl2 theo tỉ lệ 1 : 1 về số mol để tạo ra C4H9Cl.
c) Viết các công thức cấu tạo có thể có của C4H9Cl
Lời giải:
a) Công thức cấu tạo của X có thể là:
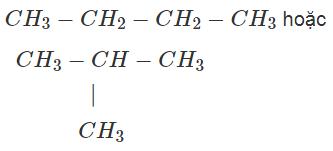
b) Phản ứng thế của X với clo theo tỷ lệ 1:1 khi chiếu sáng:
C4H10 + Cl2 → C4H9Cl + HCl
c) Vì nguyên tử clo có thể thây thế nguyên tử hidro ở vị trí bất kì trong X nên;
+ Nếu X là CH3 - CH2 - CH2 - CH3, công thức cấu tạo của C4H9Cl có thể là:
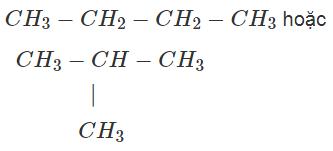

Bài 42.5 trang 52 Sách bài tập Hóa học 9: Hỗn hợp A gồm CH4, C2H2 và một hiđrocacbon X có công thức CnH2n+2. Cho 0,896 lít hỗn hợp A đi qua dung dịch brom dư để phản ứng xảy ra hoàn toàn, thấy thoát ra 0,448 lít hỗn hợp hai khí.
Biết rằng tỉ lệ số mol của CH4 và CnH2n+2 trong hỗn hợp là 1 : 1, khi đốt cháy 0,896 lít A thu được 3,08 gam khí C02 (thể tích khí đo ở đktc).
a) Xác định công thức phân tử của hiđrocacbon X.
b) Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp A.
Lời giải:
a) Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng:
C2H2 + 2Br2 → C2H2Br4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH4 và CnH2n+2
Theo đề bài ![]() \(V_{C_2H_2}\) tham gia phản ứng là: 0,896 - 0,448 = 0,448 (lít).
\(V_{C_2H_2}\) tham gia phản ứng là: 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C2H2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH4 là X. Theo bài => số mol của CnH2n+2 cũng là x.
Vậy ta có: x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp:
2C2H2 + 5O2 → 4CO2 + 2H2O
CH4 + 2O2 → CO2 + 2H2O
2CnH2n+2 + (3n+1)O2 → 2![]() \(n_{CO_2}\) + 2(n+1)H2O
\(n_{CO_2}\) + 2(n+1)H2O
Vậy ta có: ![]() \(n_{CO_2}\) = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
\(n_{CO_2}\) = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C2H6.
b) Tính % thể tích các khí:
%![]() \(V_{C_2H_2}\) = 0,448/0,896 x 100% = 50%
\(V_{C_2H_2}\) = 0,448/0,896 x 100% = 50%
%![]() \(V_{CH_4}\) = %
\(V_{CH_4}\) = %![]() \(V_{C_2H_6}\) = 25%
\(V_{C_2H_6}\) = 25%
Bài 42.6 trang 52 Sách bài tập Hóa học 9: Hiđrocacbon A, B mạch hở có tỉ khối đối với H2 tương ứng là 22 và 13.
a) Xác định công thức phân tử và công thức cấu tạo của A, B.
b) Dẫn 5,6 lít hỗn hợp A, B có tỉ khối đối với H2 là 18,4 qua dung dịch nước brom dư sao cho phản ứng xảy ra hoàn toàn. Hãy tính khối lượng brom đã tham gia phản ứng (biết thể tích khí đo ở đktc).
Lời giải:
a) Ta có MA = 22x2 = 44 gam/mol; MB = 13x2 = 26 gam/mol
Gọi công thức của A là CxHy => 12x + y = 44 => x = 3; y = 8
Công thức của A là C3H8
- Tương tự ta có công thúc của B là C2H2
Công thức cấu tạo của B là CH≡CH
b) Gọi số mol của C2H2 có trong hỗn hợp là x → ![]() \(n_{C_3H_8}\) = 5,6/22,4 - x(mol)
\(n_{C_3H_8}\) = 5,6/22,4 - x(mol)
Ta có:
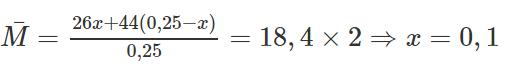
Phương trình hóa học:
C2H2 + 2Br2 → C2H2Br4
Vậy ![]() \(m_{Br_2}\) đã phản ứng là: 0,2 x 160 = 32(gam)
\(m_{Br_2}\) đã phản ứng là: 0,2 x 160 = 32(gam)
Mời các bạn tham khảo tài liệu sau: Hóa học lớp 9, Giải bài tập Hóa học 9, Tài liệu học tập lớp 9, Đề thi giữa kì 1 lớp 9, Đề thi học kì 1 lớp 9







