Giải Sách bài tập Hóa học 9 bài 27: Cacbon
Giải Sách bài tập Hóa học lớp 9 bài 27: Cacbon
Giải Sách bài tập Hóa học 9 bài 27: Cacbon được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi trong sách bài tập nằm trong chương trình giảng dạy môn Hóa học 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây
Bài 27.1 trang 33 Sách bài tập Hóa học 9: Người ta đã căn cứ vào tính chất vật lí và tính chất hoá học của than để sử dụng than trong thực tế đời sống như thế nào? Cho thí dụ.
Lời giải:
- Dựa vào khả năng hấp phụ của than để hấp phụ các chất độc (dùng trong mặt nạ phòng độc), loại chất bẩn trong lọc đường, lọc dầu thực vật, làm xúc tác cho phản ứng giữa các chất khí.
- Phản ứng của than với oxi toả nhiều nhiệt cho nên từ lâu than được dùng làm chất đốt, làm nguyên liệu trong quá trình luyện quặng thành gang.
- Cacbon dùng làm chất khử: 3C + Fe2O3 → 3CO + 2Fe
Nhiệt độ càng cao, tính khử của cacbon càng mạnh. Người ta dùng cacbon để điều chế một số kim loại từ oxit của chúng.
Bài 27.2 trang 33 Sách bài tập Hóa học 9: Viết phương trình hoá học của các phản ứng sau và cho biết tính chất hoá học của cacbon (là chất oxi hoá hay chất khử)
(1) C + CO2 to→ CO
(2) C + Fe2O3 to→ Fe + CO
(3) C + CaO to→ CaC2 + CO
(4) C + PbO to→ Pb + CO2
(5) C + CuO to→ Cu + CO2
Lời giải:
(1) C + CO2 to→ 2CO
(2) 3C + Fe2O3 to→ 2Fe + 3CO
(3) 3C + CaO to→ CaC2 + CO
(4) C + 2PbO to→ 2Pb + CO2
(5) C + 2CuO to→ 2Cu + CO2
Bài 27.3 trang 33 Sách bài tập Hóa học 9: Trong quá trình luyện quặng sắt thành gang, người ta dùng CO làm chất khử. Hãy tính thể tích khí CO (đktc) có thể thu được từ 1 tấn than chứa 90% cacbon, nếu hiệu suất của cả quá trình phản ứng là 85%.
Lời giải:
Khối lượng cacbon trong 1 tấn than: 1000 x 90/100 = 900 kg
2C + O2 → 2CO
2 x 12kg 2 x22,4m3
900kg x m3
x = 900 x 2 x 22,4/(2x12) = 1680 (m3)
Thực tế, thể tích khí CO thu được là: 1680 x 85/100 = 1428 (m3)
Bài 27.4 trang 33 Sách bài tập Hóa học 9: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
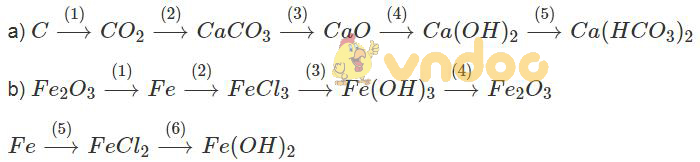
Lời giải:
Phương trình hóa học:
a)
(1) C + O2 to→ CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CaCO3 to→ CaO + CO2
(4) CaO + H2O → Ca(OH)2
(5) Ca(OH)2 + 2CO2 → Ca(HCO3)2
b)
(1) Fe2O3 + 3H2 → 2Fe + 3H2O
(2) 2Fe + 3Cl2 → 2FeCl3
(3) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
(4) 2Fe(OH)3 to→ Fe2O3 + 3H2O
(5) Fe + HCl → FeCl2 + H2
(6) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Bài 27.5 trang 34 Sách bài tập Hóa học 9: Cho hơi nước đi qua than nóng đỏ, người ta thu được hỗn hợp khí CO và H2 (hình 3.3).
a) Viết phương trình hoá học.
b) Tính thể tích hỗn hợp khí (đktc) thu được ở phản ứng trên khi dùng hết 1 tấn than chứa 92%
Lời giải:
a) Phương trình hóa học:
C + H2O to→ CO + H2
b) Thể tích hỗn hợp khí thu được.
Trong 1000 kg than có: 1000 x 92/100 = 92 kg cacbon
C + H2O → CO + H2
12g 22,4l 22,4l
12kg 44,8m3
920kg 44,8 x 920/12 = 3434,7 (m3) hỗn hợp khí
Thể tích hỗn hợp khí thực tế thu được: 3434,7 x 85/100 = 2919,5 m3
Bài 27.6 trang 34 Sách bài tập Hóa học 9: Cho 268,8 m3 hỗn hợp khí CO và H2 khử sắt(III) oxit ở nhiệt độ cao.
a) Viết phương trình hoá học.
b) Tính khối lượng sắt thu được.
Lời giải:
a) Phương trình hóa học:
3CO + Fe2O3 to→ 3CO2 + 2Fe (1)
3H2 + Fe2O3 to→ 3H2O + 2Fe (2)
b) Tổng hợp (1) và (2) ta có:
Cứ 3 x 22,4 m3 hỗn hợp khí CO và H2 qua Fe2O3 thì thu được 2 x 56 kg Fe. 268,8 m3 hỗn hợp khí CO và H2 qua Fe2O3 thì thu được x kg Fe.
x = 268,8 x 2 x 56/(3x22,4) = 448(kg) Fe
Bài 27.7 trang 34 Sách bài tập Hóa học 9: Đem nung hỗn hợp hai oxit CuO và ZnO có tỉ lệ số mol là 1 : 1 với cacbon trong điều kiện thích hợp để oxit kim loại bị khử hết, thu được hỗn hợp chất rắn X. Cho X tác dụng với dung dịch HCl dư thấy thoát ra 2,24 lít khí (ở đktc). Hãy tính khối lượng mỗi oxit kim loại.
Lời giải:
Sơ đồ phản ứng: ZnO, CuO C→ Zn, Cu
Zn + 2HCl → ZnCl2 + H2
![]() \(n_{H_2}\) = 2,24/22,4 = 0,1 mol
\(n_{H_2}\) = 2,24/22,4 = 0,1 mol
nZn = 0,1 mol
Theo đề bài, ZnO, CuO có tỷ lệ số mol là 1:1 nên Zn và Cu cũng có tỉ lệ số mol 1:1
=> nCu = nZn = 0,1 mol
mCuO = 8g; mZnO = 8,1g
Mời các bạn tham khảo tài liệu sau: Hóa học lớp 9, Giải bài tập Hóa học 9, Tài liệu học tập lớp 9, Đề thi giữa kì 1 lớp 9, Đề thi học kì 1 lớp 9







