Giải Sách bài tập Hóa học 9 bài 37: Etilen
Giải Sách bài tập Hóa học lớp 9 bài 37: Etilen
Giải Sách bài tập Hóa học 9 bài 37: Etilen được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi trong sách bài tập nằm trong chương trình giảng dạy môn Hóa học 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây
Bài 37.1 trang 46 Sách bài tập Hóa học 9: Etilen là chất
A. Có khối lượng riêng lớn hơn không khí.
B. Không màu, dễ tan trong nước.
C. Mùi hắc, ít tan trong nước.
D. Không màu, không mùi, ít tan trong nước.
Lời giải:
Đáp án D.
Bài 37.2 trang 46 Sách bài tập Hóa học 9: Có các chất sau: CH4; CH3 - CH3; CH2 = CH2; CH2 = CH - CH3.
a) Chất nào tác dụng được với clo khi chiếu sáng?
b) Chất nào có thể làm mất màu dung dịch brom?
c) Chất nào có phản ứng trùng hợp?
Hãy viết phương trình hoá học minh hoạ.
Lời giải:
- Tác dụng với clo khi chiếu ánh sáng là CH4; C2H6.
CH4 + Cl2 → CH3Cl + HCl
C2H6 + Cl2 → C2H5Cl + HCl
- Làm mất màu dung dịch brom: CH2 = CH2; CH2 = CH - CH3.
CH2 = CH2; CH2 = CH - CH3
CH2 = CH2 + Br2 → CH2Br - CH2Br
CH2 = CH - CH3 + Br2 → CH2BrCHBr - CH3
- Có phản ứng trùng hợp là CH2 = CH2; CH2 = CH - CH3.
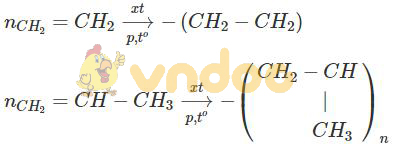
Bài 37.3 trang 47 Sách bài tập Hóa học 9: Dẫn từ từ a gam mỗi khí CH4, C2H2, CH2=CH-CH3 vào ba bình tương ứng X, Y, Z chứa cùng một lượng dung dịch brom. Sau khi kết thúc thí nghiệm thấy dung dịch trong các bình
A. X, Y, z bị mất màu.
B. X, Y mất màu, z không đổi màu.
C. X không đổi màu, Y mất màu, z nhạt màu.
D. X không đổi màu, Y nhạt màu, z mất màu.
Lời giải:
Bài 37.4 trang 47 Sách bài tập Hóa học 9: Hỗn hợp A gồm CH4 và C2H4. Đốt cháy hoàn toàn 3,36 lít hỗn hợp Ạ (đktc) rồi cho sản phẩm đi qua dung dịch Ca(OH)2 dư, thấy tạo ra 20 gam kết tủa. Hãy tính thành phần % thể tích của mỗi khí trong hỗn hợp.
Lời giải:
Gọi số mol của CH4 trong hỗn hợp là X, của C2H4 trong hỗn hợp là y.
Tính số mol CO2 tạo ra khi đốt CH4, C2H4 theo x, y. Từ đó lập hệ phương trình, tính được:
x = 0,1; y = 0,05.
=> %![]() \(V_{CH_4}\) = 66,67%; %
\(V_{CH_4}\) = 66,67%; %![]() \(V_{C_2H_4}\) =33,33%.
\(V_{C_2H_4}\) =33,33%.
Bài 37.5 trang 47 Sách bài tập Hóa học 9: Chất hữu cơ X khi đốt cháy tuân theo phương trình hoá học:
aX + 3O2 → 2CO2 + 2H20
Hãy xác định công thức phân tử của X và viết phương trình hoá học. Biết a là số nguyên, dương.
Lời giải:
Áp dụng nguyên tắc bảo toàn đối với nguyên tố oxi => trong X không có oxi. Vậy X là hiđrocacbon, có công thức phân tử CnHm. Từ phương trình hoá học của phản ứng cháy, ta có:
=> an = 2; am = 4
Nếu a = 1 thì n = 2; m = 4 → C2H4 (phù hợp)
Nếu a = 2 thì n = 1; m = 2 → CH2( không phù hợp)
Vậy công thức phân tử của X là C2H4
Bài 37.6 trang 47 Sách bài tập Hóa học 9: Dẫn 6,72 lít một hỗn hợp khí gồm hai hiđrocacbon mạch hở (không phải mạch vòng) qua dung dịch brom dư sao cho phản ứng xảy ra hoàn toàn. Sau thí nghiệm, thấy khối lượng bình đựng dung dịch brom tăng thêm 5,6 gam, đồng thời thoát ra 2,24 lít một chất khí. Mặt khác, nếu đốt cháy toàn bộ 6,72 lít hỗn hợp trên thấy tạo ra 22 gam CO2 và 10,8 gam H20. Biết các thể tích khí đo ở đktc.
Xác định công thức phân tử của hai hiđrocacbon và tính thành phần % về thể tích của mỗi chất trong hỗn hợp
Lời giải:
Thể tích khí đã tác dụng với dung dịch brom là: 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là: 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là:
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C2H4.
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH4.
%C2H4 = 4,48/6,72 x 100% = 66,67%; ![]() \(V_{CH_4}\) = 33,33%
\(V_{CH_4}\) = 33,33%
Bài 37.7 trang 47 Sách bài tập Hóa học 9: Hỗn hợp X gồm hai hiđrocacbon mạch hở, trong phân tử ngoài các liên kết đơn chỉ chứa một liên kết đôi. Đốt cháy hoàn toàn 8,96 lít hỗn hợp X thu được 40,6 gam khí CO2. Biết số mol của hiđrocacbon có số nguyên tử cacbon lớn hơn chiếm 25% tổng số mol của hỗn hợp. Tính khối lượng của 8,96 lít hồn hợp X. Xác định công thức của hai hiđrocacbon trên.
Lời giải:
Gọi công thức của hai hiđrocacbon là CnH2n, CmH2m với m > n > 2
Phương trình hoá học:
CnH2n + 3n/2 O2 → ![]() \(n_{CO_2}+m_{H_2O}\)
\(n_{CO_2}+m_{H_2O}\)
CmH2m + 3m/2 O2 → ![]() \(m_{CO_2}+m_{H_2O}\)
\(m_{CO_2}+m_{H_2O}\)
nhh = 8,96/22,4 = 0,4 mol
![]() \(n_{C_mH_{2n}}\) = 0,4/100 x 25 = 0,1 mol
\(n_{C_mH_{2n}}\) = 0,4/100 x 25 = 0,1 mol
![]() \(n_{C_nH_{2n}}\)= 0,4 - 0,1 = 0,3 mol
\(n_{C_nH_{2n}}\)= 0,4 - 0,1 = 0,3 mol
Theo phương trình hóa học: ![]() \(n_{H_2O}=n_{CO_2}\) = 40,6/44 = 0,9 mol
\(n_{H_2O}=n_{CO_2}\) = 40,6/44 = 0,9 mol
Vậy 8,96 lít hỗn hợp X có khối lượng:
mX = mC + mH = 0,9 x 12 + 0,9 x 2 = 12,6g
Ta có ![]() \(n_{CO_2}\) = 0,3n + 0,1m = 0,9 => 3n + m = 9
\(n_{CO_2}\) = 0,3n + 0,1m = 0,9 => 3n + m = 9
=> n = 2; m = 3. Công thức của 2 hidrocacbon C2H4 và C3H6
Mời các bạn tham khảo tài liệu sau: Hóa học lớp 9, Giải bài tập Hóa học 9, Tài liệu học tập lớp 9, Đề thi giữa kì 1 lớp 9, Đề thi học kì 1 lớp 9







