Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Phú Thọ lần 2



Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Phú Thọ lần 2 được VnDoc tổng hợp, biên soạn kèm đáp án, hướng dẫn lời giải chi tiết. Gồm 40 câu hỏi trắc nghiệm nằm trong tổ hợp môn thi Khoa học tự nhiên.
Hy vọng với Đề thi thử THPT Quốc gia năm 2020 môn Hóa sẽ cung cấp thêm một nguồn tài liệu ôn tập cho các em cho kì thi THPT Quốc gia môn Hóa học sắp tới thật tốt nhất.
Đề thi có trong file tải vui lòng ấn tải link để tải đề thi và hướng dẫn giải chi tiết
Đề thi thử THPT Quốc gia năm 2020 môn Hóa
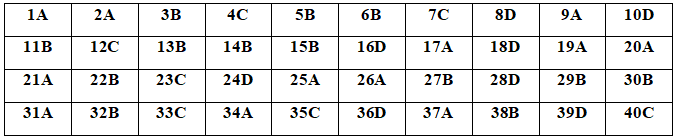
Đáp án đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Phú Thọ lần 2
Hướng dẫn lời giải chi tiết đề thi thử THPT Quốc gia môn Hóa học năm 2020 Sở GD&ĐT Phú Thọ lần 2
Câu 1. Kim loại nào sau đây không tác dụng với dung dịch FeSO4?
A. Cu.
B. Mg.
C. Zn.
D. Al.
Hướng dẫn giải
Các kim loại yếu hơn Fe không đẩy được Fe ra khỏi muối FeSO4
Câu 4. Thủy phân este C6H5CH2COOCH2CH3, thu được ancol có công thức là
A. CH3C6H4OH.
B. C3H7OH.
C. C2H5OH.
D. C6H5CH2OH.
Hướng dẫn giải
Câu 5. Ở nhiệt độ thường, bột Fe tan hoàn toàn trong lượng dư dung dịch nào sau đây?
A. KOH.
B. H2SO4 loãng.
C. MgCl2.
D. Fe(NO3)2.
Hướng dẫn giải
Câu 7. Chất nào sau đây phản ứng được với dung dịch NaOH và dung dịch HCl?
A. Ba(NO3)2.
B. MgCl2.
C. KHCO3.
D. K2CO3.
Hướng dẫn giải
Câu 10. Sục khí CO2 vào dung dịch nào sau đây thu được kết tủa?
A. MgSO4.
B. AlCl3.
C. Na2SO4.
D. NaAlO2.
Hướng dẫn giải
Câu 14. Cho dung dịch KOH vào dung dịch muối sunfat X, lúc đầu thấy xuất hiện kết tủa màu trắng xanh, sau đó chuyển sang màu nâu đỏ trong không khí. Công thức hóa học của X là
A. Fe2(SO4)3.
B. FeSO4.
C. CuSO4.
D. MgSO4.
Hướng dẫn giải
Câu 15. Cặp chất nào sau đây cùng tồn tại trong một dung dịch
A. NaH2PO4 và KOH.
B. Cu(NO3)2 và HNO3.
C. Al(NO3)3 và NH3.
D. Ba(OH)2 và H3PO4.
Hướng dẫn giải
Các chất không phản ứng với nhau có thể cùng tồn tại trong 1 ding dịch
Câu 21. Cho m gam Fe tác dụng hoàn toàn với dung dịch HNO3, thu được 0,1 mol NO2 (sản phảm khửduy nhátcủa N+5) và còn 2,2 gam Fe không tan. Giá trị của m là
A. 5,0.
B. 4,0.
C. 2,8.
D. 10,6.
Hướng dẫn giải
Bte: (pư) => nFe (pư) = 0,05 => mFe = 0,05.56 + 2,2 = 5 gam
Câu 22. Cho 5,0 gam hỗn hợp X gồm Cu và Al vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 3,36 lít khí H2 (đktc). Khối lượng của Cu trong X là
A. 2,7 gam.
B. 2,3 gam.
C. 4,05 gam.
D. 0,95 gam.
Hướng dẫn giải
Chỉ có Al tác dụng với H2SO4
Câu 24. Cho các phát biểu sau:
(a) Muối phenylamoni clorua không tan trong nước. (muối này tan tốt)
(b) Tất cả các peptit đều có phản ứng màu biure. (đipeptit không có)
(c) Hợp chất H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit. (đipeptit phải tạo bởi 2 gốc amino axit)
(d) Ở nhiệt độ thường, các amino axit đều là những chất lỏng. (amino axit là các chất rắn)
(e) Amino axit thuộc loại hợp chất hữu cơ tạp chức.
(g) Muối đinatri của axit glutamic dùng làm gia vị thức ăn (mì chính). (muối mononatri mới dùng làm bột ngọt)
Số phát biểu sai là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 25. Lên men m gam glucozơ với hiệu suất 80%, thu được 150 ml ancol etylic 46° (khối lượng riêng của ancol etylic bằng 0,8 g/ml). Giá trị của m là
A. 135.
B. 108.
C. 235.
D. 293.
Hướng dẫn giải
(pư) = 0,6 mol => m = 0,6.180/80%=135 gam
Câu 26. Cho 0,1 mol Ala-Glu tác dụng hoàn toàn với dung dịch KOH (dư, đun nóng), thu được m gam muối. Giá trị của m là
A. 35,0.
B. 12,7.
C. 22,3.
D. 33,6.
Hướng dẫn giải
Muối gồm AlaK (0,1); GluK2 (0,1) => mmuối = 35 gam
Câu 29. Hòa tan hoàn toàn một loại quặng sắt trong dung dịch HNO3 (đặc, dư, đun nóng), thu được NO2 (khí duy nhất thoát ra) và dung dịch X. Cho dung dịch BaCl2 dư vào X, không thấy có kết tủa. Quặng đã hòa tan là
A. pirit.
B. manhetit.
C. xiđerit.
D. hematit.
Hướng dẫn giải
Hemantit chứa Fe2O3 không tạo NO2 nên loại
Xiderit (FeCO3) tạo NO2 và CO2 (loại)
Pirit (FeS2) tạo có kết tủa với BaCl2 (loại)
Câu 31. Nung 33,4 gam hỗn hợp Al, Fe và Cu trong không khí, thu được m gam hỗn hợp X chỉ chứa các oxit. Hòa tan hoàn toàn X cần vừa đủ 800 ml dung dịch H2SO4 1M. Giá trị của m là
A. 46,2.
B. 41,4.
C. 39,8.
D. 45,4.
Hướng dẫn giải
Câu 32. Este X có công thức phân tử C10H8O4. Biết 0,1 mol X phản ứng tối đa với 0,3 mol NaOH, thu được dung dịch Y chứa hai muối có phân tử khối hơn kém nhau 114 đvC và một anđehit no, đơn chức, mạch hở. Cho Y tác dụng với dung dịch AgNO3 dư trong NH3 (đun nóng), thu được m gam kết tủa. Giá trị của m là
A. 16,2.
B. 43,2.
C. 27,0.
D. 64,8.
Hướng dẫn giải
X là este 2 chức, tác dụng với NaOH theo tỉ lệ 1:3 nên X chứa 1 este của phenol
Hai muối hơn kém nhau 114đvC nên X:
Muối nhỏ là HCOONa; muối lớn là NaO-C6H4-COONa ; anđehit là CH3CHO, mỗi chất 0,1 mol
Câu 34. Cho khí CO qua m gam hỗn hợp X gồm FeO, Fe2O3 và Fe3O4 nung nóng, một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ba(OH)2 dư, đến phản ứng hoàn toàn, thu được 11,82 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc, nóng (dư), thu được 1,008 lít khí SO2 (sản phẩm khử duy nhất ở đktc) và dung dịch chứa 18,0 gam muối. Giá trị của m là
A. 7,44.
B. 7,12.
C. 6,48.
D. 13,84.
Hướng dẫn giải
nO (bị lấy) =
=> mX = mFe + mO(Y) + mO (bị lấy) = 7,44 gam
Câu 35. Hỗn hợp E gồm triglixerit X, axit panmitic và axit stearic. Đốt cháy hoàn toàn m gam E, thu được 0,78 mol CO2 và 0,76 mol H2O. Mặt khác, m gam E tác dụng vừa đủ với dung dịch chứa 0,045 mol KOH, kết thúc phản ứng lấy dung dịch đem cô cạn, thu được hỗn hợp hai muối khan. Phần trăm khối lượng của muối có phân tử khối nhỏ hơn trong hỗn hợp là
A. 64,501%.
B. 32,308%.
C. 64,615%.
D. 70,769%.
Hướng dẫn giải
X có k = 3 và các axit béo có k = 1 nên:
Muối gồm
Ngoài ra các bạn có thể tham khảo thêm một số đề thi thử năm 2020 môn Hóa học mới nhất của các trường THPT
- Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Trường THPT Chuyên Hạ Long, Quảng Ninh
- Đề thi thử THPT Quốc gia năm 2020 môn Hóa học cụm Sóc Sơn Hà Nội
Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Phú Thọ lần 2 là đề thi THPT quốc gia vẫn bám sát theo khung đề thi THPT Quốc gia do Bộ GD&ĐT đưa ra trước đó, với đề thi này sẽ dễ chịu hơn hơn cho các bạn học sinh.
Trên đây VnDoc đã giới thiệu Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Phú Thọ lần 2 tới bạn đọc. Để có kết quả cao hơn trong kì thi, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Hóa học, Thi THPT Quốc gia môn Vật Lý, mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Quyết tâm đỗ Đại Học Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.

