Hình dạng của orbital
Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
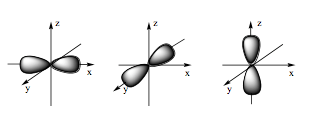
Hình số tám nổi là hình dạng của orbital p.
Vndoc.com xin gửi tới bạn đọc Đề thi cuối học kì 1 môn Hóa 10, cùng nhau luyện tập và xem kết quả nha!
Hình dạng của orbital
Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?

Hình số tám nổi là hình dạng của orbital p.
Xác định hydroxide có tính acid yếu hơn
Tổng số hạt cơ bản trong hai ion Q3- và R- là 102, trong đó số hạt mang điện nhiều hơn hạt không mang điện là 34. Mặt khác, số hạt mang điện của Q ít hơn số hạt mang điện của R là 4 hạt. Trong các hydroxide tương ứng của các nguyên tố Q và R (ứng với hóa trị cao nhất của các nguyên tố), hydroxide có tính acid yếu hơn hydroxide còn lại:
Theo bài ra ta có:
2PQ + NQ + 3 + 2PR + NR + 1 = 102 (1)
2PQ + 3 + 2PR + 1 – NQ – NR = 34 (2)
2PR – 2PQ = 4 (3)
Từ (1) và (2) ⇒ 4PQ + 4PR = 128 (4)
Từ (3) và (4) ⇒ PQ = 17 (Cl), PR = 15 (P)
Hydroxide tương ứng của các nguyên tố Q và R (ứng với hóa trị cao nhát của các nguyên tố) lần lượt là HClO4 và H3PO4.
H3PO4 có tính acid yếu hơn HClO4.
Loại liên kết biểu diễn bằng các đường nét đứt
Các liên kết biểu diễn bằng các đường nét đứt được minh họa như hình dưới đây có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
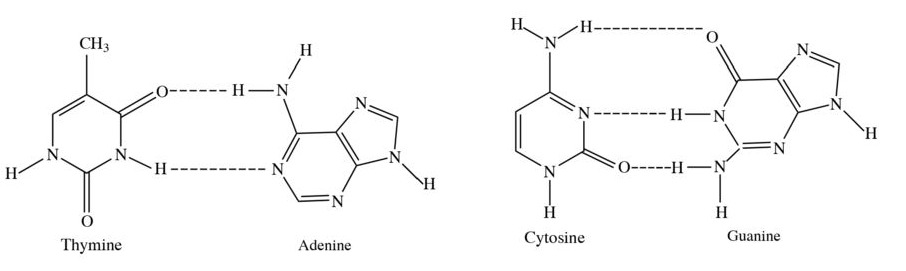
Liên kết biểu diễn bằng các đường nét đứt là liên kết hydrogen.
Sự biến đổi độ âm điện của các nguyên tố
Sự biến đổi độ âm điện của các nguyên tố: 11Na, 12Mg, 13Al, 15P, 17Cl là
Các nguyên tố: 11Na, 12Mg, 13Al, 15P, 17Cl thuộc cùng một chu kì 3.
⇒ Độ âm điện tăng dần.
Tính số khối của đồng vị còn lại
Trong tự nhiên tìm được hai đồng vị của nguyên tố X. Khảo sát cho thấy cứ 100 nguyên tử của X thì có 73 nguyên tử 63X. Biết rằng nguyên tử khối trung bình của X là 63,546; số khối của đồng vị còn lại là
Gọi số khối của đồng vị còn lại là X:
Theo bài ra ta có:
X = 65
Trong sodium hydride nguyên tử sodium có cấu hình bền của khí hiếm
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride nguyên tử sodium có cấu hình bền của khí hiếm
Sodium có cấu hình electron: 1s22s22p63s1
Khi tham gia hình thành liên kết hóa học, sodium có khuynh hướng nhường 1 electron để đạt được cấu hình electron giống với khí hiếm neon.
Xác định vị trí của nguyên tử G trong bảng tuần hoàn
Nguyên tử nguyên tố G có cấu hình electron là [Ne] 3d14s2. Vị trí của G trong bảng tuần hoàn là:
G có cấu hình electron: [Ne] 3d14s2 ⇒ Z = 21
G có Z = 21 ⇒ G ở ô thứ 21;
G có 4 lớp electron ⇒ G ở chu kì 4;
G là nguyên tố d, có 3 electron hóa trị ⇒ G ở nhóm IIIB
Cấu hình electron của nguyên tử iron
Iron (Fe) là chất đóng vai trò quan trọng trong việc tổng hợp huyết sắc tố là hemoglobin nhằm vận chuyển oxygen cho các mô và cơ quan trong cơ thể người. Cấu hình electron của nguyên tử iron (Z = 26) là
Iron có Z = 26 ⇒ Cấu hình electron: 1s22s22p63s23p63d64s2.
Acid yếu nhất
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
Nhận thấy các acid đã là các acid của các nguyên tố nhóm A, chu kì 3 (các nguyên tố ở hóa trị cao nhất).
Xu hướng biến đổi tính acid, tính base của hydroxide: trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base có xu hướng giảm dần.
⇒ H2SiO3 có tính acid yếu nhất.
Phân tử giữa halogen nào với hydrogen có độ phân cực nhất
Cho giá trị độ âm điện tương đối theo Pauling của các nguyên tố sau: F (3,98); Cl (3,16); Br (2,96); I (2,68) và H (2,20). Phân tử giữa halogen nào với hydrogen có độ phân cực nhất?
Hiệu độ âm của
H với F: 3,98 – 2,20 = 1,78
H với Cl: 3,16 – 2,20 = 0,96
H với Br: 2,96 – 2,20 = 0,76
H với I: 2,68 – 2,20 = 0,48
Hiệu độ âm điện của H và F lớn nhất nên độ phân cực của H và F lớn nhất.
Tính chất đặc trưng của Y
Một mol nguyên tử của nguyên tố Y có chứa 361,32.1022 electron (hằng số Avogadro bằng 6,022.1023). Tính chất đặc trưng của Y là
Một mol nguyên tử của nguyên tố Y có chứa 361,32.1022 electron
⇒ Một nguyên tử chứa:
⇒ Y là C, Y là phi kim.
Số hạt mang điện nhiều hơn số hạt không mang điện
Nguyên tử của nguyên tố hóa học X có tổng các hạt proton, electron, neutron bằng 180, trong đó tổng các hạt mang điện gấp 1,432 lần số hạt neutron. Số hạt mang điện nhiều hơn số hạt không mang điện bao nhiêu hạt?
X có tổng số các hạt là 180 ⇒ n + p + e = 180
Mà số p = số e ⇒ 2p + n = 180 (1)
X có tổng các hạt mang điện gấp 1,432 lần số hạt neutron:
⇒ p + e = 1,432n ⇒ 2p = 1,432n (2)
Từ (1) và (2) ⇒ p = e = 53; n = 74
Tổng số hạt mang điện là p + e = 106
Tổng số hạt không mang điện là n = 74
Số hạt mang điện nhiều hơn số hạt không mang điện là 106 – 74 = 32 hạt.
Chu kì
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron.
Xác định nguyên tố X
Một nguyên tố X tạo hợp chất khí với hydrogen có công thức XH3. Nguyên tố này chiếm 25,93% theo khối lượng trong oxide bậc cao nhất. Nguyên tố X là
Hợp chất với hydrogen là XH3 ⇒ Công thức cao nhất của X với oxygen là: X2O5
Ta có:
⇒ MX = 14
⇒ X là nguyên tố nitrogen.
Phân tử có các nguyên tử đều đạt cấu hình bão hòa
Phân tử nào sau đây có các nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
Trong phân tử BeH2 nguyên tử Be chưa đạt octet.
Phân tử AlCl3 nguyên tử Al chưa đạt octet.
Trong phân tử PCl5, lớp ngoài cùng của P có 10 electron, không tuân theo quy tắc octet
Năng lượng liên kết của phân tử F2 là 159 kJ/mol cho biết điều gì
Năng lượng liên kết của phân tử F2 là 159 kJ/mol cho biết điều gì?
Xác định công thức XY
Trong hợp chất ion XY (X là kim loại, Y là phi kim), số electron của cation bằng số electron của anion và tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có xu hướng nhận electron. Công thức XY là
Vì Y là phi kim nên Y dễ nhận thêm electron tạo thành anion. Y chỉ có xu hướng nhận electron nên Y phải là F (Z = 9).
Vì tổng số electron trong XY là 20 nên:
EX + EY = 20 ⇒ EX = 20 – 8 = 11 (Na)
Vậy XY là NaF.
Kí hiệu của lớp electron thứ 4
Lớp electron thứ 4 có kí hiệu là gì?
Kí hiệu mỗi lớp electron:
- Lớp thứ nhất gọi là lớp K.
- Lớp thứ hai gọi là lớp L.
- Lớp thứ ba gọi là lớp M.
- Lớp thứ tư gọi là lớp N.
Liên kết hóa học giữa các nguyên tử trong phân tử CH4
Liên kết hóa học giữa các nguyên tử trong phân tử CH4 là loại liên kết nào? (biết độ âm điện của nguyên tử H là 2,2 và C là 2,55)?
∆χ = 2,55 – 2,2 = 0,35 < 0,4
Vậy liên kết hóa học giữa C và H trong phân tử CH4 là liên kết cộng hóa trị không phân cực.
Tính số chất tạo được liên kết hydrogen
Cho các chất sau: CH4, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là
Các chất tạo được liên kết hydrogen là: H2O, NH3, C2H5OH
- H2O: Phân tử nước có hai nguyên tử H liên kết với nguyên tử O (có độ âm điện lớn) nên mỗi nguyên tử H trong phân tử nước này có thể tạo liên kết hydrogen với nguyên tử O trong phân tử nước khác. Bên cạnh đó, nguyên tử O còn 2 cặp electron chưa liên kết nên có thể tạo 2 liên kết hydrogen với nguyên tử H trong 2 phân tử nước khác.
- NH3: Nguyên tử N có độ âm điện lớn làm cho liên kết N-H phân cực mạnh, trong phân tử NH3 nguyên tử N còn cặp electron chưa liên kết nên có thể tạo liên kết hydrogen giữa các phân tử NH3 với nhau.
- C2H5OH: Nguyên tử H gắn với nguyên tử O có độ âm điện cao nên H đó linh động, có thể tham gia tạo liên kết với O trong phân tử C2H5OH khác.
- CH4: có độ âm điện nhỏ nên liên kết C-H phân cực yếu, nguyên tử C không còn cặp electron chưa liên kết nên không có khả năng tạo liên kết hydrogen giữa các phân tử CH4 với nhau
- PF3 không tạo được liên kết hydrogen vì không có nguyên tử H linh động.
Xác định các nguyên tử thuộc cùng một nguyên tố hóa học
Cho các nguyên tử sau:
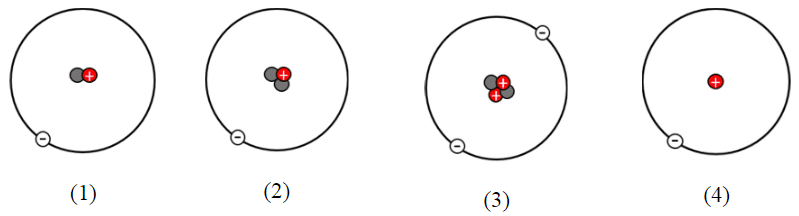
Những nguyên tử thuộc cùng một nguyên tố hóa học là
Các nguyên tử thuộc cùng một nguyên tố hóa học khi chúng có cùng số proton.
⇒ Các nguyên tử thuộc cùng một nguyên tố hóa học là: (1), (2) và (4).
Phân tử chất chỉ có các liên kết cộng hóa trị phân cực
Phân tử chất nào sau đây chỉ có các liên kết cộng hóa trị phân cực?
Ta có:
0,4 < = 3,44 - 2,55 = 0,89 < 1,7
H2O là hợp chất cộng hóa trị phân cực.
Tìm nhận định không đúng
Nhận định nào sau đây không đúng?
Nguyên tử hydrogen không chứa neutron.
Công thức hợp chất tạo thành từ X, Y và liên kết trong phân tử
Cho hai nguyên tố X: Z = 20, Y: Z = 17. Công thức hợp chất tạo thành từ X, Y và liên kết trong phân tử lần lượt là:
X (Z = 20): 1s22s22p63s23p64s2
⇒ X thuộc nhóm IIA ⇒ X là kim loại điển hình
Y (Z = 17): 1s22s22p63s23p5
⇒ Y thuộc nhóm VIIA ⇒ X là phi kim điển hình
Vậy liên kết hoá học giữa X và Y là liên kết ion có công thức là XY2.
Kí hiệu của nguyên tử lithium
Lithium đã được sử dụng để làm giảm nhiệt độ nóng chảy của thủy tinh, nguyên tử lithium có số hiệu nguyên tử là 3, số neutron 4. Kí hiệu nguyên tử của lithium là
Kí hiệu chung của nguyên tử X: , với Z là số hiệu nguyên tử, A là số khối.
Số khối của lithium là: A = Z + N = 3 + 4 = 7
⇒ Kí hiệu nguyên tử của lithium là .
Chiều giảm dần tính phi kim của các nguyên tố
Cho các nguyên tố 9F, 14Si, 16S, 17Cl. Chiều giảm dần tính phi kim của chúng là
Trong cùng 1 nhóm, theo chiều tăng của điện tích hạt nhân thì tính phi kim giảm dần
Cl < F
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân thì tính phi kim tăng dần:
Si < S < Cl
Vậy tính phi kim giảm dần: F > Cl > S > Si.
Kí hiệu phân lớp
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ
tự là
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ
tự là s, p, d, f.
Xác định nhóm của nguyên tố T
Hydroxide của nguyên tố T có tính base mạnh và tác dụng được với dung dịch HCl theo tỉ lệ mol giữa hydroxide của T và HCl là 1 : 2. Nhóm của T trong bảng tuần hoàn là
Hydroxide của nguyên tố T có tính base mạnh ⇒ công thức có dạng: T(OH)x
T(OH)x + xHCl ⟶ TClx + xH2O
Mà tỉ lệ mol giữa hydroxide của T và HCl là 1 : 2 ⇒ x = 2
⇒ T có hóa trị II mà hydroxide của T có tính base mạnh ⇒ T thuộc nhóm IIA.
Họ nguyên tố của X
Nguyên tử nguyên tố X có cấu hình electron 1s22s22p63s23p3. X thuộc họ nguyên tố nào?
Nguyên tử nguyên tố X có cấu hình electron phân lớp ngoài cùng là np3 thuộc nguyên tố p.
⇒ X thuộc họ nguyên tố p.
Mô hình mô tả quá trình tạo liên kết hóa học của nguyên tử
Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết
hóa học của nguyên tử nào?
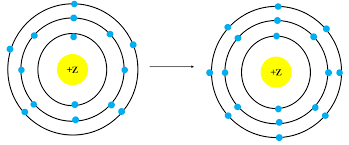
Theo mô hình mô tả ta thấy nguyên tử này có 15 electron và nhận thêm 3 electron để đạt lớp vỏ thỏa mãn quy tắc octet.
Mô hình mô tả quá trình tạo liên kết hóa học của P.
Xác định liên kết giữa X và Y
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là
X có 11 electron p cấu hình của X: 1s22s22p63s23p5 (Cl)
Y có 5 electron s cấu hình của Y: 1s22s22p63s1 (Na)
X là phi kim điển hình; Y là kim loại điển hình. Vậy liên kết hình thành giữa X và Y là liên kết ion.
Tìm phát biểu không đúng
Cho các nguyên tố sau: Na (Z = 11), Al (Z = 13), Cl (Z = 17). Phát biểu nào sau đây không đúng?
Na (Z = 11): 1s22s22p63s1 ⇒ Ô số 11, chu kì 3, nhóm IA
Al (Z = 13): 1s22s22p63s23p1 ⇒ Ô số 13, chu kì 3, nhóm IIIA
Cl (Z = 17): 1s22s22p63s23p5 ⇒ Ô số 17, chu kì 3, nhóm VIIA
Nhận thấy cả 3 nguyên tố đều cùng thuộc chu kì 3 nhưng khác nhóm.
Trong một chu kì theo chiều tăng dần điện tích hạt nhân:
- Độ âm điện tăng dần ⇒ Thứ tự tăng dần về độ âm điện là: Na < Al < Cl.
- Bán kính nguyên tử giảm dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là Na: > Al > Cl.
- Tính base của các oxide giảm dần ⇒ Thứ tự tăng dần về tính base là Cl2O7 < Al2O3 <Na2O.
- Tính acid của hydroxide tăng dần ⇒ Thứ tự tăng dần về tính acid là NaOH < Al(OH)3 < HClO4.
Nguyên tử có xu hướng nhường 1 electron
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 1 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Z = 12: 1s22s22p63s2
Z = 9: 1s22s22p5
Z = 11: 1s22s22p63s1
Z = 8: 1s22s22p4
Ta thấy nguyên tử có Z = 11 thì có 1 electron ở lớp ngoài cùng Có xu hướng nhường 1 electron.
Nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố
Nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố là sự biến đổi tuần hoàn
Nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố là sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng.
Đối tượng nghiên cứu hóa học
Đối tượng nào là đối tượng nghiên cứu của hóa học?
Đối tượng nghiên cứu của hóa học là chất và sự biến đổi chất.
Công thức oxide với hóa trị cao nhất của Y
Nguyên tố Y thuộc nhóm VIIA. Công thức oxide với hóa trị cao nhất của Y là
Do A thuộc nhóm VIIA nên công thức oxide với hóa trị cao nhất của A là Y2O7.
Xác định hai kim loại
Cho 0,64 gam hỗn hợp kim loại X, Y (cùng thuộc một nhóm IIA và ở hai chu kì kế tiếp) tác dụng với dung dịch HCl dư, thu được 495,8 ml H2 (đkc). Hai kim loại là
nH2 = 0,02 (mol)
Gọi chung hai kim loại là R (hóa trị II).
R + 2HCl → RCl2 + H2
0,02 ← 0,02
X, Y cùng thuộc một nhóm IIA và ở hai chu kì kế tiếp ⇒ X và Y lần lượt là Mg và Ca.
Xác định nhóm của X trong bảng tuần hoàn
Nguyên tử nguyên tố X có chứa 9 proton và 10 hạt neutron. X thuộc nhóm nào trong bảng tuần hoàn?
Nguyên tử nguyên tố X có chứa 9 proton và 10 hạt neutron ⇒ X có 9 electron.
Cấu hình electron của X là: 1s22s22p5
⇒ X thuộc nhóm VIIA trong bảng tuần hoàn.
Hạt tạo thành các tia âm cực
Hạt tạo thành tia âm cực là các hạt
Hạt tạo thành tia âm cực là hạt electron.
Sự phân bố electron vào AO
Hình vẽ nào sau đây mô tả đúng nguyên lí Pauli khi điền vào AO?

Biểu diễn cấu hình electron theo orbital: Trong một ô orbital, electron đầy tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
⇒ Hình vẽ đúng là a và b.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

