Mô hình nguyên tử và orbital nguyên tử
1. Mô hình Rutherford – Bohr
Mô hình nguyên tử của Rutherford – Bohr có các nội dung chính sau:
- Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
- Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
- Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
- Lớp thứ nhất gọi là lớp K.
- Lớp thứ hai gọi là lớp L.
- Lớp thứ ba gọi là lớp M.
- Lớp thứ tư gọi là lớp N.
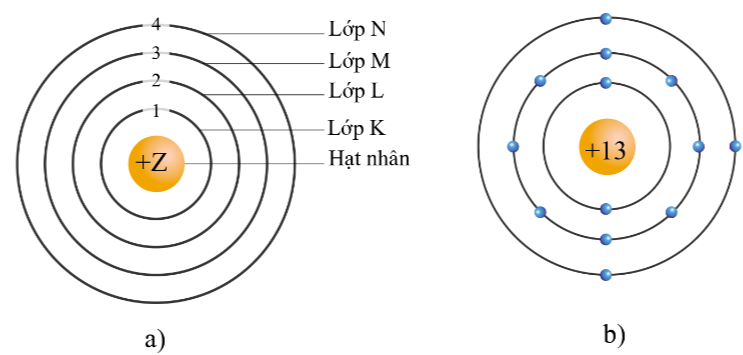
Mô hình nguyên tử theo Rutherford – Bohr (a) và cấu trúc nguyên tử aluminium (b)
Lưu ý:
Các electron được phân bố lần lượt vào lớp gần hạt nhân trước.
Ví dụ: Các electron được phân bố vào các lớp theo thứ tự: K, L, M, N, ...
Số electron tối đa trong mỗi lớp là 2n2, với n là số thứ tự lớp electron (n ≤ 4).
Ví dụ: Dựa vào công thức này tính được lớp thứ tư (lớp N, n = 4) chứa tối đa 2.42 = 32 electron.
2. Mô hình hiện đại về nguyên tử
Theo mô hình hiện đại về nguyên tử:
Các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định.
Electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.

Minh họa đám mây electron của nguyên tử hydrogen
Ví dụ: Xác suất tìm thấy electron trong đám mây electron của nguyên tử hydrogen là khoảng 90%, nghĩa là electron dù chuyển động khắp nơi trong không gian xung quanh hạt nhân nguyên tử, nhưng tập trung phần lớn ở khu vực này.
II. Orbital nguyên tử
1. Khái niệm
- Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Ví dụ: Khu vực không gian trong khối cầu xung quanh hạt nhân hydrogen mà xác suất tìm thấy electron tại đó là khoảng 90% chính là orbital của nguyên tử hydrogen.
- Orbial nguyên tử có một số hình dạng khác nhau.
+ AO hình cầu, còn gọi là AO s;
+ AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Đề - các, sẽ gọi là AO px, py và pz).
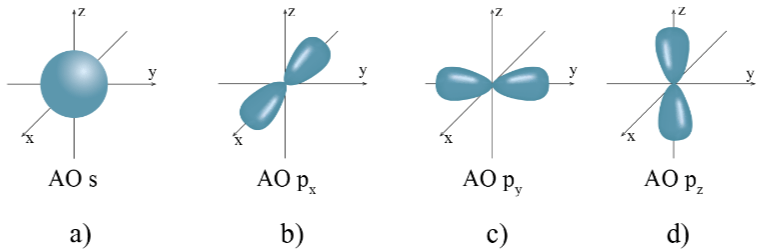
Hình dạng của AO s (a) và AO p (b; c; d)
Lưu ý:
- Orbital nguyên tử kí hiệu là AO (viết tắt của cụm từ tiếng Anh: Atomic Orbital).
- Các AO p trong cùng một lớp electron có hình dạng và kích thước tương tự nhau nhưng khác nhau về định hướng trong không gian.
- Ngoài các AO hay gặp là s và p, còn có các AO khác như d, f có hình dạng phức tạp hơn.
2. Số lượng electron trong một AO
Electron chuyển động trong AO s gọi là electron s, electron chuyển động trong AO p gọi là electron p, ...
Một AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi.
Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân.
Nếu AO không chứa electron nào thì được gọi là AO trống.





