Hóa 11 Kết nối tri thức bài 5
Hóa 11 Kết nối tri thức bài 5: Ammonia - Muối Ammonium
Hóa 11 Kết nối tri thức bài 5: Ammonia - Muối Ammonium được VnDoc.com tổng hợp và xin gửi tới bạn đọc cùng tham khảo. Từ đó có thêm tài liệu giải bài tập Hóa 11 Kết nối tri thức. Mời các bạn cùng theo dõi bài viết dưới đây.
Câu 1 trang 34 SGK Hóa 11 Kết nối
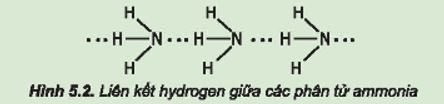
Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Lời giải
Trong phân tử nitrogen:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen.
- Liên kết N – H phân cực, cặp electron dùng chung lệch về phía nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Do đó, các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Câu 2 trang 34 SGK Hóa 11 Kết nối
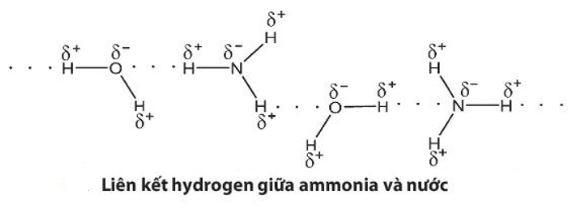
Hãy giải thích tại sao ammonia tan tốt trong nước
Lời giải
Vì tạo được liên kết hydrogen với nước nên ammonia tan nhiều trong nước.
Câu 3 trang 34 SGK Hóa 11 Kết nối
Trong hai phản ứng oxi hoá ammonia bằng oxygen ở trên, hãy:
a) Xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
Lời giải
a) Các nguyên tử có sự thay đổi số oxi hoá trong 2 phản ứng là nitrogen và oxygen.
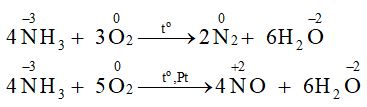
b)
4NH3 + 3O2 ![]() \(\overset{t^{0} }{\rightarrow}\) 2N2 + 6H2O
\(\overset{t^{0} }{\rightarrow}\) 2N2 + 6H2O
Quá trình oxi hoá: 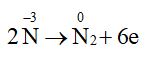
Quá trình khử: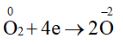
4NH3 + 5O2 ![]() \(\overset{t^{0} , Pt}{\rightarrow}\) 4NO + 6H2O
\(\overset{t^{0} , Pt}{\rightarrow}\) 4NO + 6H2O
Quá trình oxi hoá: ![]()
Quá trình khử: ![]()
Câu 4 trang 37 SGK Hóa 11 Kết nối
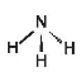
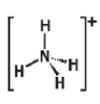
a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hoá trị, số oxi hoá của nguyên tử nitrogen.
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.
Lời giải
a)
|
Phân tử/ Ion |
Dạng hình học |
Số liên kết cộng hoá trị của nitrogen |
Số oxi hoá của nitrogen |
|
Ammonia (NH3) |
Chóp tam giác
|
3 |
-3 |
|
Ammonium (NH4+) |
Tứ diện
|
4 |
-3 |
b)
- NH3 có tính base. Một số phương trình hoá học minh hoạ:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4.
- NH4+ có tính acid. Một số phương trình hoá học minh hoạ:
NH4NO3 + NaOH ![]() \(\overset{t^{0} }{\rightarrow}\) NaNO3 + NH3 + H2O
\(\overset{t^{0} }{\rightarrow}\) NaNO3 + NH3 + H2O
NH4Cl + NaOH ![]() \(\overset{t^{0} }{\rightarrow}\) NaCl + NH3 + H2O
\(\overset{t^{0} }{\rightarrow}\) NaCl + NH3 + H2O
Phương trình ion rút gọn:
NH4+ + OH− → NH3 + H2O.
--------------------------------------
Bài tiếp theo: Hóa 11 Kết nối tri thức bài 6
Trên đây VnDoc.com vừa gửi tới bạn đọc bài viết Hóa 11 Kết nối tri thức bài 5: Ammonia - Muối Ammonium. Hi vọng qua đây bạn đọc có thể học tập tốt hơn môn Hóa học 11 Kết nối tri thức. Mời các bạn cùng tham khảo thêm tại mục Toán 11 Kết nối tri thức.