Hóa 11 Kết nối tri thức bài 7
Hóa 11 Kết nối tri thức bài 7: Sulfur và sulfur dioxide
Hóa 11 Kết nối tri thức bài 7: Sulfur và sulfur dioxide được VnDoc.com sưu tầm và xin gửi tới bạn đọc cùng tham khảo. Mời các bạn cùng theo dõi để có thêm tài liệu giải bài tập Hóa học 11 Kết nối tri thức nhé.
Mở đầu
Trong công nghiệp, sulfur là nguyên liệu ban đầu, còn sulfur dioxide là hợp chất trung gian trong quá trình sản xuất sulfuric acid. Bên cạnh đó, sulfur dioxide cũng là một tác nhân gây ô nhiễm không khí.
Vậy, tính chất cơ bản của sulfur, sulfur dioxide là gì và làm thế nào để giảm thiểu tác hại của sulfur dioxide đối với môi trường?
Bài làm
Nguyên tố sulfur tồn tại trong tự nhiên ở cả dạng đơn chất (mỏ sulfur) và dạng hợp chất (quặng sulfide, sulfate,...).
Đơn chất sulfur thể hiện tính oxi hoá (tác dụng với hydrogen, kim loại) và tính khử (tác dụng với oxygen, fluorine).
Sulfur dioxide vừa có tính oxi hoá, vừa có tỉnh khử. Sulfur dioxide là tác nhân gây ô nhiễm không khí, được sinh ra từ núi lửa và các hoạt động của con người.
Ứng dụng của sulfur: sản xuất sulfuric acid, lưu hoá cao su, sản xuất diêm, thuốc nổ, thuốc trừ sâu, diệt nấm,...
Biện pháp để giảm thiểu tác hại của sulfur dioxide đối với môi trường:
Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
I. Sulfur
1. Trạng thái tự nhiên
Câu hỏi 1: Kể tên một ứng dụng thực tiễn của quặng pyrite, thạch cao, sulfuric acid mà em biết.
Bài làm
Quặng pyrite sản xuất giấy, acid sulfuric.
Thạch cao dùng đúc tượng, bó bột.
Sulfuric acid sản xuất phân bón, luyện kim, xử lý nước thải,...
2. Cấu tạo nguyên tử, phân tử
Hoạt động nghiên cứu 1: Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
Bài làm
Cấu hình electron 1s22s22p63s23p4.
Cấu hình electron theo ô orbital: 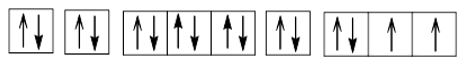
Hoạt động nghiên cứu 2: Dựa vào cấu hình elecron và độ âm điện của nguyên tử S, hãy đưa ra dự đoán về:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Tính oxi hoá, tính khử của sulfur.
Bài làm
a) Số oxi hoá của nguyên tử S trong hợp chất thấp nhất là -2, cao nhất là +6.
b) Sulfur vừa có tính oxi hoá vừa có tính khử.
Câu hỏi 2: Trong tinh thể sulfur, các phân tử S8 tương tác với nhau bằng lực Van Der Waals yếu. Hãy dự đoán về nhiệt độ nóng chảy (cao hay thấp) của đơn chất sulfur.
Bài làm
Sulfur dễ nóng chảy, sulfur nóng chảy ở nhiệt độ 113oC.
3. Tính chất vật lí
4. Tính chất hóa học
Hoạt động thí nghiệm: Sulfur tác dụng với sắt (iron)
Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
Tiến hành:
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:
Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
Sản phẩm tạo thành FeS.
PTHH: S + Fe → FeS
So + 2e → S2−
Fe → Fe2+ + 2e
Chất oxi hóa: S; Chất khử: Fe.
Hoạt động thí nghiệm: Thí nghiệm: Sulfur tác dụng với oxygen
Chuẩn bị: bột sulfur, bình khí oxygen, muôi sắt, đèn cồn, nút cao su.
Tiến hành:
- Lấy một ít bột sulfur vào muôi sắt (đã cắm xuyên qua nút cao su).
- Hơ nóng muôi sắt trên ngọn lửa đèn cồn đến khi sulfur nóng chảy và chảy một phần trong không khí.
- Đưa nhanh muôi sắt vào bình khí oxygen.
Quan sát và thực hiện các yêu cầu:
1. Viết phương trình hoá học và xác định chất oxi hoá, chất khử.
2. Nhận xét mức độ phản ứng cháy của sulfur trong không khí và trong khí oxygen.
Bài làm
1. Phương trình: S + O2 → SO2
So → S2+ + 2e
O2 + 4e → 2O2−
Chất oxi hóa: oxygen; Chất khử: sulfur
2. Nhận xét mức độ phản ứng cháy của sulfur:
Sulfur cháy trong không khí: với ngọn lửa nhỏ, màu xanh nhạt.
Sulfur cháy trong oxygen: mãnh liệt hơn, tạo thành khí sulfur dioxide.
Câu hỏi 3: Phản ứng của sulfur với hydrogen, nhôm (aluminium), thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Bài làm
| Phản ứng | Sự thay đổi số oxi hóa | Sulfur là chất oxi hóa/chất khử |
| H2 + S → H2S |
Ho → H+ + 2e So + 2e → S2− |
Chất oxi hóa |
| 2Al + 3S → Al2S3 |
Alo → Al3+ + 3e So + 2e → S2− |
Chất oxi hóa |
| Hg + S → HgS |
Hgo → Hg2+ + 2e So + 2e → S2− |
Chất oxi hóa |
| S + 3F2 → SF6 |
So → S6+ + 6e Fo + e → F- |
Chất khử |
5. Ứng dụng
Hoạt động nghiên cứu: Sưu tầm thông tin và trình bày về ứng dụng của một hợp chất có chứa nguyên tố sulfur trong thực tiễn.
Bài làm
THẠCH CAO
Thạch cao có tên gọi khoa học chính thức là Calcium Dihydrate (CTHH: CaSO4.2H2O), được biết đến là khoáng thạch cao. Trong đó, 79.1% Calcium Sunfat và 20.9% còn lại là nước. Khi mang đi nung ở nhiệt độ 150°C ta sẽ thu được thạch cao khan, chứa 79.0%.
Tính chất của Calcium Dihydrate bao gồm:
- Khối lượng mol là 136,142 g/mol (khan)
- Khối lượng riêng là 2,96 g/cm3.
- Điểm nóng chảy là 1460 °C (khan).
- Ứng dụng của thạch cao trong đời sống
Hiện nay, thạch cao được sử dụng rộng rãi trong đời sống. Sau đây là một số ứng dụng nổi bật:
Sử dụng trong ngành xây dựng: Thạch cao được sử dụng phổ biến trong ngành xây dựng. Điển hình là để làm trần thạch cao hoặc tấm la phong trang trí cho các công trình.
Sản phẩm làm từ thạch cao có tác dụng cách âm, cách nhiệt, chống ẩm,… an toàn cho con người. Và sản phẩm này cũng rất dễ trong di chuyển, thi công.
Trong ngành điêu khắc, đúc tượng: Thạch cao cũng được sử dụng rộng rãi trong đúc tượng và điêu khắc. Vì thạch cao có trọng lượng nhẹ nên khi tạo khuôn hay đổ thạch cao để tạo ra bức tượng có tính thẩm mỹ rất cao.
Dùng thạch cao có thể đảm bảo được độ cứng cho tượng. Tuy nhiên, trong quá trình thực hiện thì người làm cần đổ và trét 2 lớp thạch cao và sử dụng tay nghề của mình để cho ra sản phẩm.
Sử dụng trong ngành y tế: Thạch cao còn được ứng dụng trong ngành y tế. Người ta dùng thạch cao để bó bột cho những trường hợp như: Gãy tay, chân, các chấn thương liên quan tới xương khớp. Thạch cao có độ kết dính cao và nhanh nên rất phù hợp.
II. Sulfur Dioxide
Hoạt động nghiên cứu 1: Sulfur dioxide là oxide acid (acidic oxide). Viết phương trình hoá học minh họa.
Bài làm
SO2 + H2O → H2SO3
Hoạt động nghiên cứu 2: Dựa vào số oxi hoá của sulfur trong hợp chất sulfur dioxide, hãy dự đoán tính oxi hoá, tính khử của sulfur dioxide.
Bài làm
Số oxi hóa của sulfur trong sulfur dioxide là S4+.
→ Sulfur dioxide vừa có tính oxi hóa vừa có tính khử.
Câu hỏi 4: Hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố và vai trò của sulfur dioxide trong phản ứng của sulfur dioxide với hydrogen sulfide và nitrogen dioxide.
Bài làm
(1) SO2 + 2H2S → 3S + H2O
S4+ + 4e → So
S2− → So + 2e
Vai trò của sulfur dioxide: chất oxi hóa.
(2) SO2 + NO2 → SO3 + NO (xúc tác)
S4+ → S6+ + 2e
N4+ + 2e → N2+
Vai trò của sulfur dioxide: chất khử.
Câu hỏi 5: a) Trình bày ứng dụng của sulfur dioxide. Giải thích.
b) Kể tên một số nguồn phát thải sulfur dioxide vào khí quyển. Em hãy đề xuất một số biện pháp nhằm cắt giảm sự phát thải đó.
Bài làm
a) Ứng dụng:
Sulfur dioxide là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
Do có khả năng tẩy trắng và diệt khuẩn, sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,...
Trong nghiên cứu, sulfur dioxide lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
b) Một số nguồn phát thải sulfur dioxide vào khí quyển:
Nguồn sulfur dioxide từ nhiên: khí thải núi lửa.
Nguồn sulfur dioxide nhân tạo: chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid,..
Biện pháp nhằm cắt giảm sự phát thải:
Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo
Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên
Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
---------------------------------------------
Bài tiếp theo: Hóa 11 Kết nối tri thức bài 8
Trên đây VnDoc.com vừa gửi tới bạn đọc bài viết Hóa 11 Kết nối tri thức bài 7: Sulfur và sulfur dioxide. Hi vọng qua bài viết này bạn đọc có thêm tài liệu để học tập tốt hơn môn Hóa học 11 Kết nối tri thức. Mời các bạn cùng tham khảo thêm tại mục Toán 11 Kết nối tri thức, Vật lý 11 Kết nối tri thức.








