Công thức tính nồng độ mol và nồng độ phần trăm
Bài tập tính nồng độ mol và nồng độ phần trăm
Công thức tính nồng độ mol và nồng độ phần trăm được VnDoc biên soạn 2 công thức tính nồng độ mol và nồng độ dung dịch. Đây là 2 công thức điển hình của Hóa học 8 được sử dụng trong các bài tập dung dịch khi đề bài yêu cầu tính nồng độ mol và nồng độ dung dịch. Tài liệu cung cấp cho các em kiến thức cơ bản kèm các bài tập liên quan cho các em ôn luyện. Hy vọng tài liệu này sẽ giúp các em khái quát, ghi nhớ một cách dễ dàng từ đó vận dụng hiệu quả vào các bài tập.
- Tổng hợp công thức Hóa học 8 cần nhớ
- Hoá học 8 Bài 42 Nồng độ dung dịch
- Các bài tập về lượng chất dư Hóa học 8
- Bài tập ôn hè môn Hóa học lớp 8 lên lớp 9
NỒNG ĐỘ DUNG DỊCH
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Thực hành tính Nồng độ Mol
Cách thực hiện:
- Chọn Lượng chất tan
- Chọn Thể tích dung dịch
Lưu ý: Bạn có thể chọn Chất tan ở ô Drink mix
I. Nồng độ phần trăm (C%)
Nồng độ phần trăm của dung dịch là số gam chất tan có trong 100 gam dung dịch
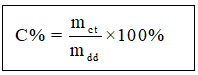
Trong đó:
mct là khối lượng chất tan
mdd là khối lượng dung dịch
mdd = mdm + mct
Ví dụ 1: Hòa tan 15 gam muối vào 50 gam nước. Tính nồng độ phần trăm của dung dịch thu được:
Hướng dẫn giải chi tiết bài tập
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
![]()
![]()
Ví dụ 2: Người ta hòa tan 40 gam muối và nước được dung dịch có nồng độ 20%.
a) Tính khối lượng dung dịch nước muối thu được.
b) Tính khối lượng nước cần dùng cho sự pha chế trên.
Hướng dẫn giải chi tiết bài tập
a) Khối lượng dung dịch nước muối thu được là:
![]()
c) khối lượng nước cần dùng cho sự pha chế trên là:
mdd - mct = 200 - 40 = 160 gam
Ví dụ 3: Trộn 50 gam dung dịch muối ăn có nồng độ 20% với 50 gam dung dịch muối ăn 10%. Tính nồng độ phần trăm của dung dịch thu được?
Hướng dẫn giải chi tiết bài tập
Số gam muối ăn có trong 50 gam dung dịch muối ăn nồng độ 20% là:
![]()
Số gam muối ăn có trong 50 gam dung dịch muối ăn nồng độ 10% là:
![]()
Dung dịch muối ăn thu được sau phản ứng là: mdd1 + mdd2 = 50 + 50 = 100 gam
Nồng độ % dung dịch muối ăn sau khi trộn là:

Ví dụ 4. Hòa tan 25 gam đường vào nước được dung dịch nồng độ 50%
Hãy tính:
a) Khối lượng dung dịch đường pha chế được.
b) Khối lượng nước cần dùng cho sự pha chế.
Hướng dẫn giải chi tiết bài tập
Từ công thức m dd = (mct.100%)/C%
a. Khối lượng dung dịch đường pha chế được
mdd = (25.100)/50 = 50 (gam)
b. Khối lượng nước cần dùng cho sự pha chế:
m dm = mdd - m đường = 50 -25 = 25 (gam)
Ví dụ 5. Hòa tan CaCO3 vào 200 gam dung dịch HCl 7,3% (vừa đủ)
a. Viết phương trình hóa học
b. Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Hướng dẫn giải chi tiết bài tập
Khối lượng của HCl có trong 200 gam dung dịch HCl 7,3% là
mHCl = (C%.mdd)/100% = 200.7,3/100 = 14,6 (gam) => nHCl = 0,4 mol
Phương trình: CaCO3 + 2HCl → CaCl2 + H2O + CO2
nCaCO3 = nCaCl2 = nCO2 = 1/2nHCl = 0,2 mol -> mCaCO3 = 20 gam
mCaCl2 = 0,2.111 = 22,2 gam
mCO2= 0,2.44 = 8,8 gam
Khối lượng dung dịch sau phản ứng là:
m dd sau phản ứng = mCaCO3 + mdd HCl - mCO2 = 20 + 200 - 8,8 = 211,2 gam
Nồng độ của CaCl2 là: C% dd CaCl2 = (22,3.100%)/(211.2) = 10,51%
Ví dụ 6. Tiến hành thí nghiệm cho 400 gam dung dịch NaOH 20% tác dụng vừa đủ với 200 gam dung dịch HCl, phản ứng sinh ra NaCl và H2O. Tính nồng độ muối sinh ra sau phản ứng.
Hướng dẫn giải chi tiết bài tập
Khối lượng NaOH là:
mNaOH = mdd.C%/100 = 400.20/100 = 80 gam
=> Số mol NaOH là: nNaOH = 80/40 = 3 mol
Phương trình hóa học phản ứng: NaOH + HCl → NaCl + H2O
Theo phương trình hóa học: 1mol → 1mol → 1mol
Muối thu được sau phản ứng là NaCl
mNaCl = 2.58,5 = 117 gam
Do phản ứng không sinh ra chất khí hay kết tủa nên khối lượng dung dịch sau phản ứng là:
mdd sau pứ = mdd NaOH + mdd HCl = 400 + 200 = 600 (gam)
=> Nồng độ dd NaCl sau phản ứng là: C%ddNaCl = 117/600.100% = 19,5 %
II. Nồng độ mol (CM )
Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
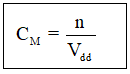
Trong đó: CM là nồng độ mol
n là số mol chất tan
Vdd là thể tích dung dịch (lít)
Ví dụ 1: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch CuSO4 chứa 100 gam CuSO4
Hướng dẫn giải chi tiết bài tập
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch CuSO4 = 0,625 : 0,5 = 1,25M
Ví dụ 2: Tính khối lượng H2SO4 có trong 100 ml dung dịch H2SO4 2M
Hướng dẫn giải chi tiết bài tập
Số mol của H2SO4 là = 0,1 x 2 = 0,2 mol
Khối lượng của H2SO4 = 0,2 x 98 = 19,6 gam
Ví dụ 3: Trộn 200 ml dung dịch H2SO4 4M vào 4 lít dung dịch H2SO4 0,25M. Nồng độ mol của dung dịch mới là
Hướng dẫn giải chi tiết bài tập
Số mol H2SO4 2 lít dung dịch H2SO4 4M là
0,2 : 4 = 0,8 mol
Số mol H2SO4 4 lít dung dịch H2SO4 0,25M là
4 : 0,25 = 1 mol
Thể tích sau khi trộn dung dịch là: 4 + 0,2 = 4,2 lít
Nồng độ mol của dung dịch mới là: ( 0,8 + 1) : 4,2 = 0,43M
Ví dụ 4. Cho 6,5 gam kẽm phản ứng vừa đủ với 100 mol dung dịch axit HCl
a. Tính thể tích H2 thu được ở điều kiện tiêu chuẩn
b. Tính nồng độ mol của dung dịch HCl đã dùng.
Hướng dẫn giải chi tiết bài tập
Số mol của Zn là: nZn = 6,5/65 = 0,1 mol
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2
nZn = nZnCl2 = 0,1 mol, nHCl = 2.nZn = 0,2 mol
a. VH2 = 0,1 . 22,4 = 2,24 (lít)
b. CM (dd HCl) = 0,2/0,1 = 2M
III. Bài tập vận dụng liên quan
Câu 1: Trộn lẫn 100 gam dung dịch H2SO4 10% với 200 gam dung dịch H2SO4 C% thu được dung dịch H2SO4 30%. Tính C%.
Hướng dẫn giải chi tiết bài tập
mddH2SO4.24,5% = 200 .1,12 = 224 (g)
⇒ mH2SO4.24,5% = 224 . 24,5% = 54,88 (g)
mH2SO4.10% = 26×10% = 2,6(g)
Ta có: mddH2SO4mới = 224 + 26 = 250(g)
mH2SO4mới = 54,88 + 2,6 = 57,48(g)
⇒C%H2SO4mới = 57,48/250×100% = 22,992%
Câu 2: Cho D = m/v. Lập công thức thể hiện mối quan hệ giữa C% và CM.
Hướng dẫn giải chi tiết bài tập
Ta có: Lấy V lít hay 1000V ml dung dịch
=> Khối lượng dung dịch là: mdd = 100V. D
Khối lượng chất tan là: ![]()
Số mol của chất tan là: ![]()
Ta có:

Câu 3: Trong Cho m gam NaCl vào nước được 200 gam dung dịch NaCl 15%. Tính nồng độ mol của dung dich NaCl. Biết dung dich NaCl có D= 1,1g/ml.
Hướng dẫn giải chi tiết bài tập
m NaCl = 200. 15/100= 30g
=> n NaCl = 0,5 mol
Vdd NaCl = mdd / D = 200/ 1,1 = 181,8 ml = 0,182 l
=> Nồng độ mol = 0,5/ 0,182 = 2,75 (M)
Câu 4: Trộn 2 lít dung dịch đường 0,5M với 3 lit dung dịch đường 1M. Tính nồng độ mol của dung dịch đường sau khi trộn?
Hướng dẫn giải chi tiết bài tập
Tính số mol đường có trong dung dịch 1:
n1 = CM 1.Vdd 1 = 0,5.2 = 1 mol
Tính số mol đường có trong dung dịch 2:
n2 = CM 2.Vdd 2 = 1.3=3 mol
Tính số mol đường có trong dung dịch 3:
n3 = n1 + n2 = 1+3 = 4 mol
Tính thể tích dung dịch 3
Vdd 3 = Vdd 1 + Vdd 2 = 2 + 3 = 5 lit
Tính nồng độ mol dung dịch 3
CM = n : V = 4: 5 = 0,8 M
Câu 5: Tính nồng độ mol của dung dịch
a. 1 mol KCl trong 750ml dung dịch
b. 0,5 mol MgCl2 trong 1,5 lít dung dịch
c. 0,06 mol trong 1500 ml dung dịch
Hướng dẫn giải chi tiết bài tập
Đổi 750 ml = 0,75 lít
CM = 1/0,75 = 1,33 mol/l
b. CM = 0,5/1,5 = 0,33 mol/l
c. Đổi 1500 ml = 1,5 lít
CM = 0,06/1,5 = 0,04 mol/l
Câu 6: Tính nồng độ phần trăm của các dung dịch sau
a. 20 gam KCl trong 600 gam dung dịch
b. 32 gam KNO3 trong 2 Kg dung dịch
c. 75 g K2CO3 trong 1500 gam dung dịch
Hướng dẫn giải chi tiết bài tập
a) C%KCl = mct/mdd.100 = 20/600.100 = 10/3 ≈ 3,33%
b) Đổi: 2kg = 2000 g
C%NaNO3 = 32/2000.100 = 1,6%
c)C%K2SO4 = 75/1500.100 = 5%
Câu 7: Đun nhẹ 20 gam dung dịch CuSO4 cho đến khi nước bay hơi hết thu được 3,6 gam chất rắn. Xác định nồng độ phần trăm của dung dịch CuSO4.
Hướng dẫn giải chi tiết bài tập
CuSO4 khan là chất tan.
Nồng độ phần trăm của dung dịch CuSO4 là:
C% = 3,6/20.100 = 18%
Vậy: Nồng độ phần trăm của dung dịch CuSO4 trên là 18%
Câu 8: Trung hòa 30ml dung dịch H2SO4 1m cần dung 50 ml dung dịch NaOH:
a) Viết phương trình hóa học
b) Tính nồng độ dung dịch NaOH đã dùng
c) Nếu trung hòa dung dịch H2SO4 ở trên bằng dung dịch KOH 5,6% có khối lượng riêng 1,045g/ml thì cần bao nhiêu ml KOH
Hướng dẫn giải chi tiết bài tập
Phương trình hóa học
a) 2NaOH + H2SO4 → Na2SO4 + 2H2O
b)
nH2SO4 = 0,03.1 = 0,03 (mol)
nNaOH = 2nH2SO4 = 0,06 (mol)
=> CMNaOH = 0,06/0,05 = 1,2M
c) H2SO4 + 2KOH → K2SO4 + 2H2O
nKOH = 2nH2SO4 = 0,06 (mol)
=> mKOH = 0,06.56 = 3,36 gam
=> mddKOH = 3,36/5,6% = 60 (gam)
=> V dung dịch KOH = m/D = 60/1,045 = 57,42 (ml)
Câu 9: Cho bao nhiêu gam NaOH vào bao nhiêu gam nước có trong 200 gam dung dịch NaOH 10%.
Hướng dẫn giải chi tiết bài tập
Khối lượng NaOH là:
mNaOH = 10.200/100 = 20 (g)
Khối lượng nước cần dùng là:
mH2O = mdd − mNaOH = 200 − 20 = 180 (g)
Câu 10: Tính
a. Khối lượng nước có trong 400 gam dung dịch CuSO4 4%
b. Khối lượng NaCl có trong 300ml dung dịch NaCl 3M
Hướng dẫn giải chi tiết bài tập
a) nCuSO4 = 400.4/100 = 16 gam
mH2O = 400 - 16 = 384 g.
b)
Vì đơn vị của nồng độ mol là mol/l nên ta đổi 300 ml thành 0,3 lít
Số mol chất tan trong 0,3 lít dung dịch NaCl 3M là
CM = nV => n = CM.V = 3.0,3 = 0,9mol
Khối lượng NaCl cần lấy là: mNaCl = n.M = 0,9.58,5 = 52,65 gam
Câu 11: Cho 6,5 gam kẽm phản ứng vừa đủ với 100 ml dung dịch axit clohiđric.
a. Tính thể tích khí hiđro thu được ở đktc?
b. Tính nồng độ mol của dung dịch muối thu được sau phản ứng?
c. Tính nồng độ mol của dung dịch axit HCl đã dùng?
Hướng dẫn giải chi tiết bài tập
nZn = m/M = 6,5/ 65 = 0,1 (mol)
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2 ↑
Theo phương trình 1 2 1 1(mol)
Phản ứng: 0,1 0,2 0,1 0,1 (mol)
a.
VH2 = n.22,4 = 0,1.22,4 = 2,24 (l)
b. Ta có nZnCl2 = nH2 = 0,1 mol => CM ZnCl2 = 0,1/0,2 = 0,5M
c. CMddHCl = n/V= 0,1/0,2 = 0,5 (M)
Câu 12: Cho 25 gam dung dịch NaOH 4% tác dụng vừa đủ tác dụng với 51 gam dung dịch H2SO4 0,2M (có thể tích 52 ml). Tính nồng độ % các chất trong dung dịch sau phản ứng?
Hướng dẫn giải chi tiết bài tập
mNaOH = 25.4% =1 gam
=> nNaOH = 1/40 = 0,025 mol
nH2SO4 = 0,2.52/1000 = 0,0104 mol
Phương trình phản ứng
2NaOH + H2SO4 → Na2SO4 + 2H2O
Ban đầu: 0,025 mol
Phản ứng: 0,0208 mol ← 0,0104 mol → 0,0104 mol
Sau pứ: 4,2.10-3 mol
mNaOH dư =4,2.10-3.40 = 0,168 gam
mNa2SO4 = 0,0104.142 = 1,4768 gam
mdd sau pứ = 25 + 51 = 76 gam
C%dd NaOH dư = 0,168/76.100% = 0,22%
C%dd Na2SO4 = 1,4768/76.100% = 1,943%
Câu 13: Hòa tan 6 gam magie oxit (MgO) vào 50 ml dung dịch H2SO4 (có d = 1,2 g/ml) vừa đủ.
a. Tính khối lượng axit H2SO4 đã phản ứng?
b. Tính nồng độ % của dung dịch H2SO4 axit trên?
c. Tính nồng độ % của dung dịch muối sau phản ứng?
Đáp án hướng dẫn giải chi tiết
a) nMgO = 6:40 =0,15 (mol)
Ta có phương trình hóa học
MgO + H2SO4 → MgSO4 + H2O
0,15......0,15...........0,15..................(mol)
Theo phương trình hóa học: mH2SO4 = 0,15.98 = 14,7g
b)Ta có: mdd H2SO4 = D.V=1,2.50 = 60 (g)
=> Nồng độ % dd H2SO4 là:
C%dd H2SO4 =14,760.100%=24,5%
c)Theo phương trình hóa học: mMgSO4 = 0,15.120=18(g)
Khối lượng dd sau pư là:
mddsau = mMgO + mddH2SO4 = 6 + 60 = 66 (g)
Câu 14: Cho 200 gam dung dịch NaOH 4% tác dụng vừa đủ với dung dịch axit H2SO4 0,2M.
a. Tính thể tích dung dịch axit cần dùng?
b. Biết khối lượng của dung dịch axit trên là 510 gam. Tính nồng độ % của chất có trong dung dịch sau phản ứng?
Đáp án hướng dẫn giải chi tiết
a) Phương trình phản ứng hóa học
2NaOH + H2SO4 → Na2SO4 + 2H2O
nNaOH = (200.4%) /40 = 0,2 (mol)
⇒nH2SO4 = 0,2 : 2 =0,1 (mol) (Theo tỉ lệ 2:12:1 )
⇒ VH2SO4 =n/CM = 0,1/0,2 = 0,5l = 500ml
b) Ta đã có:
nNaOH = 0,2 (mol)
⇒ nNa2SO4= 0,2/2 =0,1(mol) (Theo tỉ lệ 2:12:1 )
⇒mddsaupư = 510 + 200 = 710 (g)
⇒C%Na2SO4 = (0,1.142)/710.100% = 2%
.....................
+ Đầu tiên tính số mol của NaOH sau đó tính được số mol của H2SO4
+ Tính được V H2SO4 từ số mol của H2SO4 và nồng độ mol H2SO4
+ Sau đó tính được số mol của Na2SO4 và khối lượng dung dịch sau pư roii ta tính được C%
Câu 15: Cho 10,8 gam FeO tác dụng vừa đủ với 100 gam dung dịch axit clohiđric.
a. Tính khối lượng axit đã dùng, từ đó suy ra nồng độ % của dung dịch axit?
b. Tính nồng độ % của dung dịch muối thu được sau phản ứng?
................................................
VnDoc đã giới thiệu Công thức tính nồng độ mol và nồng độ phần trăm, là 2 công thức tính toán được áp dụng cho các dạng bài tập Hóa học 8 cũng như các lớp trên. Khi bài tập yêu cầu tính nồng độ mol hay nồng độ dung dịch thì các em sẽ biết cách sử dụng linh hoạt công thức vào làm bài tập. Hy vong tài liệu này sẽ giúp các em củng cố, luyện tập bài tập tính toán nồng độ dung dịch cũng như học tốt môn Hóa học hơn.
Trên đây VnDoc đã đưa tới các bạn một tài liệu rất hữu ích Công thức tính nồng độ mol và công thức tính nồng độ phần trăm. Để có kết quả học tập tốt hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 8; Chuyên đề Hóa học 8; Trắc nghiệm Hóa Học 8 online mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








