Đề thi tháng môn Hóa học lớp 10 trường THPT Ngô Sĩ Liên, Bắc Giang năm 2015 - 2016 (Lần 2)
Đề thi tháng môn Hóa học lớp 10
Đề thi tháng môn Hóa học lớp 10 trường THPT Ngô Sĩ Liên, Bắc Giang năm 2015 - 2016 (Lần 2) gồm 16 câu hỏi trắc nghiệm và 5 câu hỏi tự luận cùng đáp án đi kèm. Đây là tài liệu ôn tập môn Hóa lớp 10 hữu ích dành cho các bạn học sinh, mời các bạn tham khảo.
Đề thi khảo sát chất lượng môn Hóa học lớp 10 trường THPT Đồng Đậu, Vĩnh Phúc năm 2015 - 2016
|
SỞ GD&ĐT BẮC GIANG TRƯỜNG THPT NGÔ SĨ LIÊN Năm học 2015 - 2016 |
ĐỀ THI THỬ KỲ THI THPT QUỐC GIA LẦN 2 Môn: HÓA HỌC LỚP 10 Thời gian làm bài: 90 phút (không kể thời gian phát đề) (Học sinh không được sử dụng tài liệu) |
Mã đề thi 209
Cho số hiệu nguyên tử: N(Z = 7); O(Z = 8); F(Z = 9); Ne(Z = 10); Na(Z = 11); Mg(Z = 12); Al(Z = 13); P(Z = 15); Cl(Z = 17); Ar(Z = 18).
Cho KLNT: H = 1; C = 12; N = 14; O = 16; P = 31; S = 32, Cl = 35,5; Li = 7; Na = 23; K = 39;
Rb = 85; Be = 9; Mg = 24, Ca = 40; Sr = 88; Ba = 137; Fe = 56; Al = 27.
Câu 1: Cho các nguyên tố: X (Z = 19); Y (Z = 37); R (Z = 20); T (Z = 12). Dãy các nguyên tố sắp xếp theo chiều tính kim loại tăng dần từ trái sang phải:
A. T, X, R, Y. B. T, R, X, Y. C. Y, X, R, T. D. Y, R, X, T
Câu 2: Nồng độ phần trăm của dung dịch tạo thành khi hoà tan 39g kali vào 362g nước là:
A. 13,97% B. 10,77% C. 9,73% D. 14%
Câu 3: Dãy các nguyên tố được sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là:
A. P, N, O, F. B. P, N, F, O. C. N, P, O, F. D. N, P, F, O.
Câu 4: Nguyên tố X có điện tích hạt nhân bằng 20, nguyên tố Y có điện tích hạt nhân bằng 17. Công thức phân tử và loại liên kết trong hợp chất tạo thành bởi hai nguyên tố trên là:
A. XY2 - liên kết cộng hóa trị có cực. B. X2Y - liên kết ion.
C. XY2 - liên kết ion. D. X2Y - liên kết cộng hóa trị có cực.
Câu 5: X, Y là 2 nguyên tố kim loại thuộc cùng một nhóm A trong bảng tuần hoàn. Kết luận nào sau đây là đúng đối với X, Y? (Biết ZX < ZY và ZX + ZY = 32)
A. Bán kính nguyên tử của X > Y. B. X, Y đều có 2 electron lớp ngoài cùng.
C. Tính kim loại của X > Y. D. Độ âm điện của X < Y.
Câu 6: Số oxi hóa của N trong NO2, NO3-, NH4+ lần lượt là:
A. +1, +4, -3. B. +4, +6, +2. C. +4, +5, -3. D. +4, +5, +2.
Câu 7: Cho 8gam oxit kim loại R ở nhóm IIA tác dụng vừa đủ với 800 ml dung dịch HCl 0,5M. Kim loại R là:
A. Be B. Ba C. Mg D. Ca
Câu 8: Số hiệu nguyên tử Z của các nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây đúng?
A. M thuộc nhóm IIB. B. Q thuộc nhóm IA.
C. X thuộc nhóm VA. D. A và M đều thuộc nhóm IIA.
Câu 9: Trong tự nhiên, nguyên tố clo có hai đồng vị bền là 3517Cl và 3717Cl, trong đó đồng vị 3517Cl chiếm 75,77% về số nguyên tử. Phần trăm khối lượng của 37Cl trong CaCl2 (với KLNT của Ca = 40) là:
A. 26,16%. B. 24,23%. C. 16,16%. D. 47,80%.
Câu 10: Ion X2+ có cấu hình electron ở trạng thái cơ bản là 1s² 2s² 2p6. Nguyên tố X là:
A. Mg (Z = 12). B. Na (Z = 11). C. Ne (Z = 10). D. O (Z = 8)
Câu 11: Dãy gồm các ion và nguyên tử đều có cấu hình electron 1s²2s²2p6 là:
A. Na+, F–, Ne. B. Li+, F–, Ne. C. K+, Cl–, Ar. D. Na+, Cl–, Ar.
Câu 12: Chọn thứ tự tăng dần bán kính nguyên tử của các kim loại kiềm:
A. Li < K < Na < Rb < Cs B. Li < Na < K < Rb < Cs
C. Cs < Rb < K < Na < Li D. Li < Na < K < Cs < Rb
Câu 13: Hòa tan hoàn toàn 2,81gam hỗn hợp gồm Fe2O3, MgO trong 500ml dung dịch H2SO4 0,1M (vừa đủ). Sau phản ứng hỗn hợp muối sunfat khan thu đư ợc (sau khi cô cạn) có khối lư ợng là:
A. 5,81gam B. 3,81gam C. 4,81gam D. 6,81gam
Câu 14: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là:
A. P. B. S. C. As. D. N.
Câu 15: Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
B. Theo chiều tăng của điện tích hạt nhân.
C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
D. Cả A, B, C.
Câu 16: Tổng số hạt (proton, nơtron, electron) trong ion M3+ là 37, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 9 hạt. Vị trí của M trong bảng tuần hoàn là
A. chu kì 3, nhóm IIA. B. chu kì 3, nhóm VIA.
C. chu kì 4, nhóm IA. D. chu kì 3, nhóm IIIA.
B. PHẦN TỰ LUẬN (6 điểm). Học sinh trình bày lời giải vào tờ giấy thi.
Câu 1 (1,0 điểm). Viết PTPƯ hoàn thành sơ đồ sau:
Ca → CaO → Ca(OH)2 → CaCO3 → CaCl2 → Ca(NO3)2
Câu 2 (1,0 điểm). Viết công thức cấu tạo của các phân tử sau: Cl2, N2, HCl, CH4, CH4O.
Câu 3 (1,0 điểm). Chỉ dùng thêm một thuốc thử hãy trình bày cách nhận biết các dung dịch không màu để trong các lọ mất nhãn: HCl, H2SO4, Ba(OH)2, NaCl. Viết phương trình phản ứng xảy ra.
Câu 4 (2,0 điểm). Cho 13,7 gam hỗn hợp A gồm Na2CO3 và MgCO3 bằng 73 gam dung dịch HCl 25%. Sau khi phản ứng xảy ra hoàn toàn thì thu được 3,36 lít CO2 (đktc) và dung dịch X.
a) Viết phương trình phản ứng xảy ra và tính thành phần phần trăm khối lượng mỗi muối trong hỗn hợp A.
b) Tính nồng độ phần trăm các chất tan trong dung dịch X.
c) Tính thể tích dung dịch KOH 0,1M cần cho vào dung dịch X để thu được lượng kết tủa là lớn nhất.
Câu 5 (1,0 điểm). Hòa tan 87 g hỗn hợp 2 muối cacbonat và sunfit của cùng một kim loaị kiềm vào dd H2SO4 loãng (d ư). Toàn bộ khí thoát ra đ ược hấp thụ vừa đủ bởi 500 ml dung dịch NaOH 3 M tạo ra muối trung hòa. Tìm tên kim lọai kiềm.
Đáp án đề thi tháng môn Hóa học lớp 10
Phần trắc nghiệm:
1 - B 2 - D 3 - A 4 - C 5 - B 6 - C 7 - C 8 - B
9 - C 10 - A 11 - A 12 - B 13 - D 14 - D 15 - D 16 - D
B. PHẦN TỰ LUẬN (6 điểm).
Câu 1 (1,0 điểm). Viết PTPƯ (Mỗi PT viết đúng được 0,2 điểm, cân bằng sai hoặc chưa CB cho 0,1 đ)
2Ca + O2 → 2 CaO
CaO + H2O → Ca(OH)2
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH (có thể thay Na2CO3 bằng chất khác)
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
Câu 2 (1,0 điểm). Viết công thức cấu tạo của các phân tử sau : Cl2, N2, HCl, CH4, CH4O.
Cl-Cl; N≡N; H-Cl;
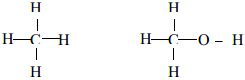
Câu 3 (1,0 điểm). Hướng dẫn:
- Dùng quỳ quỳ tím nhận ra Ba(OH)2 do làm quỳ tím chuyển màu xanh. Nhận ra NaCl do không làm quỳ tím đổi màu. (0,5 điểm)
- Còn H 2 SO 4 và HCl đều làm quỳ tím đổi màu đỏ thì dùng Ba(OH)2 nhận ra H2SO4 do có phản ứng tạo kết tủa trắng.
PTPƯ: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O (0,5 điểm)
(Có thể dùng chất khác làm thuốc thử mà đúng cũng được)
(Còn tiếp)