Giải bài tập Hóa 10 nâng cao bài 10
Hóa học 10 - Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa 10 nâng cao bài 10, nội dung tài liệu gồm 6 bài tập trang 44 SGK kèm theo đáp án sẽ giúp các bạn học sinh có kết quả cao hơn trong học tập. Mời các bạn học sinh và thầy cô cùng tham khảo.
Giải bài tập Hóa 10 nâng cao bài 6
Giải bài tập Hóa 10 nâng cao bài 7
Giải bài tập Hóa 10 nâng cao
Bài 1 (trang 44 sgk Hóa học 10 nâng cao): Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại được lặp lại giống như chu kì trước là do:
A. sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
D. sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Hãy chọn đáp án đúng.
Lời giải:
Chọn C
Bài 2 (trang 44 sgk Hóa 10 nâng cao): Dựa vào bảng 2.1, hãy cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố sau đây: H, He, Li, Na, K, Ga, O, S, Cl, Br.
Lời giải:
| Nguyên tố | H | He | Li | Na | K | Ca | O | S | Cl | Br |
| Số electron lớp ngoài cùng | 1 | 2 | 1 | 1 | 1 | 2 | 6 | 6 | 7 | 7 |
Lời giải:
| Điện tích hạt nhân | Cấu hình electron | Số thứ tự nhóm | Chu kì |
| Z = 8 | 1s22s22p4 | VIA | 2 |
| Z = 9 | 1s22s22p5 | VIIA | 2 |
| Z = 17 | 1s22s22p63s23p5 | VIIA | 3 |
| Z = 19 | 1s22s22p63s23p64s1 | IA | 4 |
Bài 4 (trang 44 sgk Hóa 10 nâng cao): Viết cấu hình electron nguyên tử của các nguyên tố có Z = 18 và Z = 19. Tại sao nguyên tố có Z = 18 ở chu kì 3, còn nguyên tố có Z = 19 lại ở chu kì 4?
Lời giải:
=> Nguyên tố này thuộc chu kì 3 vì có 3 lớp electron.
Cấu hình electron của nguyên tố có (Z = 19): ls2 2s2 2p6 3s2 3p6 4s1
=> Nguyên tố này thuộc chu kì 4 vì có 4 lớp electron.
Lời giải:
Cấu hình electron nguyên tử của các nguyên tố:
Z = 20: ls2 2s2 2p6 3s2 3p6 4s2;
Z = 21: ls2 2s2 2p6 3s2 3p6 3d1 4s2;
Z = 24: ls2 2s2 2p6 3s2 3p6 3d5 4s1;
Z = 29: ls2 2s2 2p6 3s2 3p6 3d10 4s1;
Z = 30: ls2 2s2 2p6 3s2 3p6 3d10 4s2;
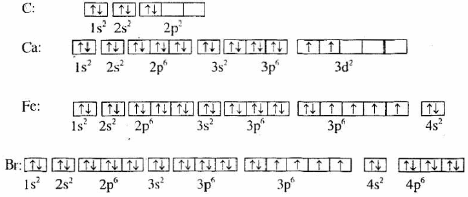
Bài 6 (trang 44 sgk Hóa 10 nâng cao): Sự phân bố electron vào các AO của nguyên tử các nguyên tố C, Ca, Fe và Br sau đây đúng hay sai? Nếu sai hãy sửa lại cho đúng.
Lời giải:
Cấu hình electron nguyên tử của nguyên tố C viết sai. Theo quy tắc Hun, 2 electron ở mức 2p phải phân bố trên 2 obitan 2p. Electron được phân bố như sau:
Cấu hình electron nguyên tử của Fe viết đúng.
Cấu hình electron nguyên tử của Br viết thừa 1 electron ở phân lớp 4p. Sửa lại như sau:

-----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 10 nâng cao bài 10. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 10, Giải bài tập Vật Lí 10, Giải bài tập Sinh học 10, Giải bài tập Hóa học 10 mà VnDoc tổng hợp và đăng tải.