Giải bài tập Hóa 10 nâng cao bài 44
Hóa học 10: Hiđro sunfua
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa 10 nâng cao bài 44, tài liệu gồm 5 bài tập trang 176, 177 SGK kèm theo đáp án sẽ giúp các bạn học sinh giải bài tập Hóa học nhanh và hiệu quả nhất. Mời các bạn học sinh và thầy cô cùng tham khảo.
Giải bài tập Hóa 10 nâng cao bài 40
Giải bài tập Hóa 10 nâng cao bài 41
Giải bài tập Hóa 10 nâng cao
Bài 1 (trang 176 sgk Hóa 10 nâng cao): Cho phản ứng hóa học: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào diễn tả đúng tính chất của các phản ứng?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
Lời giải:
Chọn D.
Bài 2 (trang 176 sgk Hóa 10 nâng cao): Bạc tiếp xúc với không khí có H2S bị biến đổi thành Ag2S màu đen:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
Câu nào diễn tả đúng tính chất của các chất phản ứng?
A. Ag là chất oxi hóa, H2S là chất khử.
B. H2S là chất khử, O2 là chất oxi hóa.
C. Ag là chất khử, O2 là chất oxi hóa.
D. H2S vừa là chất oxi hóa, vừa là chất khử, còn Ag là chất khử.
Lời giải:
Chọn C.
Bài 3 (trang 177 sgk Hóa 10 nâng cao): Dẫn khí H2S vào dung dịch hỗn hợp KMnO4 và H2SO4, nhận thấy màu tím của dung dịch chuyển sang không màu và có vẩn đục màu vàng. Hãy:
a) Giải thích hiện tượng quan sát được.
b) Viết phương trình hóa học biểu diễn phản ứng.
c) Cho biết vai trò của các chất phản ứng H2S và KMnO4.
Lời giải:
a) Giải thích hiện tượng:
- Dung dịch mất màu do KMnO4 (màu tím) sau phản ứng bị khử thành MnSO4 (không màu).
- Vẩn đục màu do H2S bị oxi hóa tạo lưu huỳnh không tan trong nước có màu vàng.
b) Phản ứng hóa học:
c) Vai trò các chất: H2S: Chất khử; KMnO4: Chất oxi hóa.
Bài 4 (trang 177 sgk Hóa 10 nâng cao): Có bốn dung dịch loãng của các muối NaCl, KNO3, Pb(NO3)2. CuSO4. Hãy cho biết có hiện tượng gì xảy ra và giải thích khi cho:
a) Dung dịch Na2S vào mỗi dung dịch các muối trên.
b) Khí H2S đi vào mỗi dung dịch các muối trên.
Lời giải:
a) Khi cho dung dịch Na2S lần lượt vào các dung dịch:
NaCl: Không có hiện tượng gì.
KNO3: Không có hiện tượng gì.
Pb(NO3)2: Có kết tủa đen do phản ứng. Pb(NO3)2 +Na2S → PbS↓(màu đen) + 2NaNO3
CuSO4: Có kết tủa màu den, dung dịch mất màu xanh, do phản ứng
CuSO4 + Na2S → CuS↓ (màu đen)+Na2SO4.
Khi cho khí H2S lần lượt vào các dung dịch:
NaCl: Không có hiện tượng gì.
KNO3: Không có hiện tượng gì.
Pb(NO3)2: Có kết tủa den do phản ứng. Pb(NO3)2 + H2S → PbS↓(màu đen) +2HNO3
CuSO4: Có kết tủa màu đen, dung dịch mất màu xanh, do phản ứng.
CuSO4 + H2S → CuS↓(màu đen) +H2SO4.
Bài 5 (trang 177 sgk Hóa học 10 nâng cao): Cho hỗn hợp FeS và Fe tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí ở điều kiện tiêu chuẩn. Dẫn hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư), sinh ra 23,9g kết tủa màu đen.
a) Viết phương trình hóa học của các phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Tính tỉ lệ số mol các khí trong hỗn hợp.
c) Tính thành phần phần trăm theo khối lượng của hỗn hợp rắn ban đầu.
Lời giải:
a) Các phản ứng xảy ra:
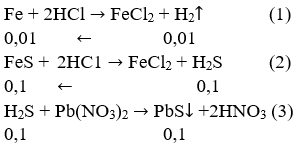
b) Hỗn hợp khí gồm H2 và khí H2S
Số mol PbS:
![]()
Số mol H2S và H2:
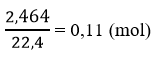
Số mol H2: 0,11 - 0,1 = 0,01 (mol).
Tỉ lệ số mol 2 khí:
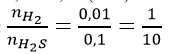
c)Theo các phản ứng (1) và (2) ta có:
nFe = ![]() \(n_{H_2}\) = 0,01 mol => mFe = 0,01.56 = 0,56(g)
\(n_{H_2}\) = 0,01 mol => mFe = 0,01.56 = 0,56(g)
nFeS = ![]() \(nH_2S\) = 0,1 mol => mFeS = 0,1.88 = 8,8(g)
\(nH_2S\) = 0,1 mol => mFeS = 0,1.88 = 8,8(g)
-----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 10 nâng cao bài 44. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 10, Giải bài tập Vật Lí 10, Giải bài tập Sinh học 10, Giải bài tập Hóa học 10 mà VnDoc tổng hợp và đăng tải.








