Giải bài tập Hóa 10 nâng cao bài 33
Hóa học 10: Luyện tập về clo và hợp chất của clo
VnDoc mời các bạn học sinh tham khảo tài liệu Giải bài tập Hóa 10 nâng cao bài 33, tài liệu gồm 6 bài tập trang 136 SGK kèm theo lời giải chi tiết sẽ là nguồn thông tin hay để phục vụ công việc học tập của các bạn học sinh được tốt hơn. Mời các bạn học sinh tham khảo.
Giải bài tập Hóa 10 nâng cao bài 29
Giải bài tập Hóa 10 nâng cao bài 30
Giải bài tập Hóa 10 nâng cao
Bài 1 (trang 136 sgk Hóa 10 nâng cao): Trong các dãy chất dưới đây, dãy nào gồm toàn các chất có thể tác dụng với clo?
A. Na, H2, N2;
B. NaOH(dd), NaBr(dd), NaI(dd);
C. KOH(dd), H2O, KF(dd);
D. Fe, K, O2
Lời giải:
Chọn B. Dãy chất tác dụng với clo là:
Cl2 + 2NaOH -> NaCl + NaClO + H2O
Cl2 + 2NaBr -> 2NaCl + Br2
Cl2 + 2NaI -> 2NaCl + I2
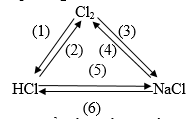
Bài 2 (trang 136 sgk Hóa học 10 nâng cao): Viết phương trình hóa học thực hiện các biến hóa:
Lời giải:
Các phản ứng xảy ra:
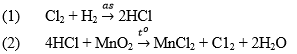
(3) Cl2 + 2Na -> 2NaCl
![]()
(5) HCl + NaOH ->NaCl + H2O
![]()
Bài 3 (trang 136 sgk Hóa 10 nâng cao): Người ta có thể điều chế KCl bằng:
a) một phản ứng hóa hợp.
b) một phản ứng phân hủy.
c) một phản ứng trao đổi.
d) một phản ứng thế.
1. Hãy dẫn ra phản ứng cho mỗi trường hợp trên.
2. Trường hợp nào là phản ứng oxi hóa-khử? Trong đó số oxi hóa của nguyên tố clo thay đổi như thế nào?
Lời giải:
1) Các phản ứng điều chế KCl
Một phản ứng hóa hợp:
![]()
Một phản ứng phân hủy:
![]()
Một phản ứng trao đổi:
![]()
Một phản ứng thế:
![]()
2) Các phản ứng (1), (2) và (4) là phản ứng oxi hóa-khử.
Trong (1): Số oxi hóa cửa clo giảm từ 0 xuống - 1.
Trong (2): Số oxi hóa của clo giảm từ +5 xuống -1.
Trong (3) và (4): số oxi hóa của clo không thay đổi.
Bài 4 (trang 136 sgk Hóa 10 nâng cao): Viết phương trình hóa học của phản ứng thực hiện các biến hóa dưới đây, ghi tên các chất và điều kiện của phản ứng.
Lời giải:
Các phản ứng xảy ra:
(1 ) NaClO + 1HCl -> NaCl + Cl2 + H2O
(2) Cl2 + 2NaOH -> NaCl + NaClO + H2O
(3) Cl2 + Ca(OH)2 rắn -> CaOCl2 + H2O
(4) CaOCl2 + ->2HCl CaCl2 + Cl2 + H2O
(5) KClO3 +6HC1 -> 3Cl2 + KCl + 3 H2O
(6) 3C12 + 6KOH ->5KCl + KClO3 + 3H2O
Tên các chất:
- NaClO: Natri hipoclorit;
- CaOCl2: Canxi clorua hipođorit
- KClO3: Kali clorat;
- NaBrO: Natri hipobromit
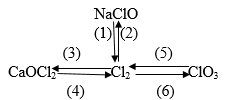
Bài 5 (trang 136 sgk Hóa 10 nâng cao): Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,10g nhôm tạo ra 37,05gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích hỗn hợp A.
Lời giải:
![]()
Đặt số mol O2 và Cl2 cần dùng lần lượt là a mol và b mol
Qúa trình nhường electron
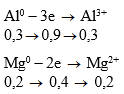
Qúa trình nhận electron
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
mAl + mMg + ![]() \(m_{O_2}\)+
\(m_{O_2}\)+ ![]() \(m_{Cl_2}\) = mZ => 8,1 + 4,8 + 32a + 71b = 37,05 (**) giải hệ (*) và (**), ta được:
\(m_{Cl_2}\) = mZ => 8,1 + 4,8 + 32a + 71b = 37,05 (**) giải hệ (*) và (**), ta được:
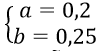
Thành phần phần trăm thể tích mỗi khí trong hỗn hợp A
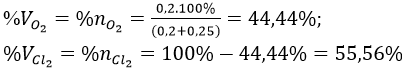
Thành phần phần trăm khối lượng mỗi khí trong hỗn hợp A
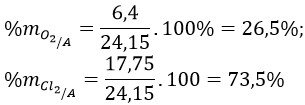
Bài 6 (trang 136 sgk Hóa 10 nâng cao): Muối ăn bị lẫn các tạp chất là Na2SO4, MgCl2, CaCl2 và CaSO4. Hãy trình bày phương pháp hóa học để loại bỏ các tạp chất, thu được NaCl tinh khiết. Viết phương trình hóa học của các phản ứng.
Lời giải:
- Cho dung dịch Na2CO3 vừa đủ vào dung dịch muối ăn có lẫn tạp chất Na2SO4, MgCl2, CaCl2, CaSO4 để loại bỏ các ion Mg2-, Ca2-.
Na2CO3 + MgCl2 -> MgCO2 + 2NaCl
Na2CO3 + CaCl2 -> CaCO3 +2NaCl
Na2CO3 + CaSO4 -> CaCO3+ Na2SO4
- Lọc bỏ kết tủa sau đó cho dung dịch BaCl2 vào dung dịch nước lọc để loại bỏ ion SO42-
BaCl2 + Na2SO4 -> BaSO4 + 2NaCl
- Lọc bỏ kết tủa BaSO4, cho dung dịch Na2CO3 vào dung dịch nước lọc (nếu còn dư BaCl2) để loại bỏ ion Ba2+.
BaCl2 + Na2CO3 -> BaCO3 + 2NaCl
- Lọc bỏ kết tủa BaCO3, cho dung dịch HCl vào dung dịch nước lọc (nếu còn dư Na2CO3) và đun nhẹ được NaCl tinh khiết.
-----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 10 nâng cao bài 33. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 10, Giải bài tập Vật Lí 10, Giải bài tập Sinh học 10, Giải bài tập Hóa học 10 mà VnDoc tổng hợp và đăng tải.