10 Bộ đề thi Hóa học kì 2 lớp 9 năm 2020 - 2021 Có đáp án Chi tiết
Bộ đề thi Hóa học kì 2 lớp 9 năm 2020 - 2021 được đội ngũ giáo viên VnDoc biên soạn là 5 đề kiểm tra Hóa học kì 2 lớp 9 có đáp án chi tiết kèm theo. Đề thi bám sát khung chương trình Hóa học 9, đảm bảo đánh giá đúng năng lực học của các em. Tài liệu cũng rất hữu ích dành cho các thầy cô tham khảo trong quá trình ôn tập, ra đề cho các em học sinh.
Đề thi Hóa học kì 2 lớp 9 có đáp án
Đề thi Hóa học kì 2 lớp 9 - Đề số 1
Phần 1: Trắc nghiệm (4 điểm)
Chọn và khoanh tròn vào chữ cái đứng trước phương án trả lời đúng
Câu 1. Etilen thuộc nhóm
A. Hidrocacbon
B. Dẫn xuất hidrocacbon
C. Chất rắn
D. Chất lỏng
Câu 2. Phát biểu nào sau đúng khi nói về metan?
A. Khí metan có nhiều trong thành phần khí quyển trái đất.
B. Trong cấu tạo phân tử metan có chứa liên kết đôi.
C. Metan cháy tạo thành khí CO2 và H2O.
D. Metan là nguồn nguyên liệu để tổng hợp nhựa PE trong công nghiệp.
Câu 3. Số công thức cấu tạo mạch hở của C4H8 là:
A. 1
B. 2
C. 3
D. 4
Câu 4. Gluxit nào sau đây có phản ứng tráng gương?
A. Tinh bột.
B. Glucozơ.
C. Xenlulozơ.
D. Saccarozo.
Câu 5. Ancol etylic tác dụng được với
A. Na
B. Al
C. Fe
D. Cu
Câu 6. Hidrocacbon A là chất có tác dụng kích thích trái cây mau chín. A là chất nào trong các chất dưới đây?
A. Etilen
B. Bezen
C. Metan
D. Axetilen
Câu 7. Glucozơ có tính chất nào dưới đây?
A. Làm đổi màu quỳ tím.
B. Tác dụng với dung dịch axit.
C. Phản ứng thủy phân.
D. Phản ứng với dung dịch AgNO3 trong NH3.
Câu 8. Nhận xét nào dưới đây là đúng khi nói về polime?
A. Đa số các polime dễ hòa tan trong các dung môi thông thường.
B. Các polime có phân tử khối rất lớn.
C. Các polime dễ bay hơi.
D. Đa số các polime không có nhiệt độ nóng chảy xác định.
Câu 9. Thể tích oxi (đktc) cần thiết đốt cháy 4,6 gam ancol etylic là:
A. 6,72 lít
B. 7,84 lít
C. 8.69 lít
D. 11,2 lít
Câu 10. Thủy phân protein trong dung dịch axit sinh ra sản phẩm là:
A. Ancol etylic.
B. Axit axetic.
C. Grixerol.
D. Amino axit.
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm) Viết phương trình hóa học thực hiện sơ đồ chuyển đối hóa học sau:
Glucozơ ![]() \(\rightarrow\) Rượu etylic
\(\rightarrow\) Rượu etylic ![]() \(\rightarrow\) Axit axetic
\(\rightarrow\) Axit axetic ![]() \(\rightarrow\) Natri axetat Metan
\(\rightarrow\) Natri axetat Metan
Câu 2. (1,5 điểm) Nhận biết các chất dưới đây bằng phương pháp hóa học:
Acol etylic, axit axetic, glucozơ
Câu 3. (2,5 điểm) Đốt cháy hoàn toàn 4,8 gam một hợp chất hữu cơ A sau phản ứng thu được 6,6 gam CO2 và 5,4 gam H2O. Biết rằng khi hóa hơi ở điều kiện tiêu chuẩn 2,24 lít khí A nặng 3,2 gam.
a) Xác định công thức phân tử của hợp chất hữu cơ A.
b) Biết rằng A có phản ứng với Na. Tính thể tích khí hidro (đktc) thoát ra khi cho lượng chất A ở trên phản ứng hoàn toàn với Na dư.
(Na = 23, O = 16, C = 16, H = 1)
Đáp án đề kiểm tra học kì 2 môn Hóa học 9 - Đề số 1
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | C | C | B | A | A | D | B | A | D |
Phần 2. Tự luận (6 điểm)
Câu 1.
(1) C6H12O6 ![]() \(\overset{men}{\rightarrow}\) 2C2H5OH + CO2
\(\overset{men}{\rightarrow}\) 2C2H5OH + CO2
(2) C2H5OH + O2 ![]() \(\overset{men}{\rightarrow}\) CH3COOH + H2O
\(\overset{men}{\rightarrow}\) CH3COOH + H2O
(3) CH3COOH + NaOH ![]() \(\rightarrow\) CH3COONa + H2O
\(\rightarrow\) CH3COONa + H2O
(4) CH3COONa + NaOH ![]() \(\overset{t ^{\circ },xt }{\rightarrow}\) CH4 + Na2CO3
\(\overset{t ^{\circ },xt }{\rightarrow}\) CH4 + Na2CO3
Câu 2.
Nhúng quỳ tím vào các chất trên, chất làm đổi màu quỳ tím thành đỏ là axit axetic. Các chất còn lại không làm đổi màu quỳ tím.
Nhỏ dung dịch AgNO3/NH3 vào các chất còn lại, chất nào xảy ra phản ứng tráng gương là glucozơ.
C6H12O6 + Ag2O ![]() \(\overset{NH_{3} }{\rightarrow}\)C6H12O7 + 2Ag ↓
\(\overset{NH_{3} }{\rightarrow}\)C6H12O7 + 2Ag ↓
Ancol etylic không phản ứng với AgNO3/NH3
Câu 3.
n CO2 = 0,15 mol
 \(\begin{array}{l}
{n_{{H_2}O}} = 0,3mol\\
\left\{ \begin{array}{l}
{m_{{C_x}{H_y}{O_z}}} = {m_C} + {m_H} + {m_O}\\
{m_C} = {n_{C{O_2}}} \times 12,{m_H} = 2{n_{{H_2}O}} \times 1,{m_O} = {n_{C{O_2}}} \times 12\\
{m_O} = {m_{{C_x}{H_y}{O_z}}} - {m_C} - {m_H}
\end{array} \right. = > \left\{ \begin{array}{l}
{m_C} = {n_{C{O_2}}} \times 12 = 0,15 \times 12 = 1,8g\\
{m_H} = 2{n_{{H_2}O}} \times 1 = 2 \times 0,3 = 0,6g\\
{m_O} = {m_{{C_x}{H_y}{O_z}}} - {m_C} - {m_H} = 2,4g
\end{array} \right.
\end{array}\)
\(\begin{array}{l}
{n_{{H_2}O}} = 0,3mol\\
\left\{ \begin{array}{l}
{m_{{C_x}{H_y}{O_z}}} = {m_C} + {m_H} + {m_O}\\
{m_C} = {n_{C{O_2}}} \times 12,{m_H} = 2{n_{{H_2}O}} \times 1,{m_O} = {n_{C{O_2}}} \times 12\\
{m_O} = {m_{{C_x}{H_y}{O_z}}} - {m_C} - {m_H}
\end{array} \right. = > \left\{ \begin{array}{l}
{m_C} = {n_{C{O_2}}} \times 12 = 0,15 \times 12 = 1,8g\\
{m_H} = 2{n_{{H_2}O}} \times 1 = 2 \times 0,3 = 0,6g\\
{m_O} = {m_{{C_x}{H_y}{O_z}}} - {m_C} - {m_H} = 2,4g
\end{array} \right.
\end{array}\)
 \(\left\{ \begin{array}{l}
x:y:z = {n_C}:{n_H}:{n_O} = \frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}}\\
= \frac{{1,8}}{{12}}:\frac{{0,6}}{1}:\frac{{2,4}}{{16}} = 1:4:1
\end{array} \right. = > \left\{ \begin{array}{l}
A:{(C{H_4}O)_n}\\
{M_A} = \frac{{3,2}}{{0,1}} = 32 = > A:C{H_4}O
\end{array} \right.\)
\(\left\{ \begin{array}{l}
x:y:z = {n_C}:{n_H}:{n_O} = \frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}}\\
= \frac{{1,8}}{{12}}:\frac{{0,6}}{1}:\frac{{2,4}}{{16}} = 1:4:1
\end{array} \right. = > \left\{ \begin{array}{l}
A:{(C{H_4}O)_n}\\
{M_A} = \frac{{3,2}}{{0,1}} = 32 = > A:C{H_4}O
\end{array} \right.\)
b) A phản ứng với Na =>A có nhóm -OH: CH3OH
 \(\left\{ \begin{array}{l}
{n_{{H_2}}} = \frac{1}{2}{n_{C{H_3}OH}} = \frac{1}{2} \times 0,15 = 0,075mol\\
{V_{{H_2}}} = 0,075 \times 22,4 = 1,68l
\end{array} \right.\)
\(\left\{ \begin{array}{l}
{n_{{H_2}}} = \frac{1}{2}{n_{C{H_3}OH}} = \frac{1}{2} \times 0,15 = 0,075mol\\
{V_{{H_2}}} = 0,075 \times 22,4 = 1,68l
\end{array} \right.\)
Đề thi Hóa học kì 2 lớp 9 - Đề số 2
Phần 1: Trắc nghiệm (4 điểm)
Chọn và khoanh tròn vào chữ cái đứng trước phương án trả lời đúng
Câu 1. Trong phân tử metan có
A. 4 liên kết đơn C-H
B. 1 liên kết đôi C=H và 3 liên kết đơn C-H
C. 2 liên kết đôi C=O và 2 liên kết đơn C-H
D. 1 liên kết đôi C=H và 3 liên kết đơn C-H
Câu 2. Đốt cháy 1 hydrocacbon được nH2O gấp đôi nCO2. Tìm công thức hydrocacbon đó là:
A.C2H6
B. CH4
C. C2H4
D. C2H2
Câu 3. Số công thức cấu tạo mạch hở của rượu có công thức C4H8O là:
A. 2
B. 3
C. 4
D. 5
Câu 4. Chọn câu trả lời đúng trong các câu trả lời sau:
A. CH4 làm mất mất màu dung dịch brom
B. C2H4 tham gia phản ứng thế với clo tương tư như CH4
C. CH4 và C2H4 đều tham gia phản ứng cháy sinh ra CO2 và H2O
D. CH4 và CO2 đều có phản ứng trùng hợp
Câu 5. Hợp chất Y là chất lỏng không màu, có nhóm – OH trong phân tử, tác dụng với kali nhưng không tác dụng với kẽm. Y là
A. NaOH.
B. CH3COOH.
C. Ca(OH)2.
D. C2H5OH.
Câu 6. Dãy chất tác dụng với axit axetic là:
A. CuO; Cu(OH)2; Cu; CuSO4; C2H5OH.
B. CuO; Cu(OH)2; Zn; H2SO4; C2H5OH.
C. CuO; Cu(OH)2; Zn; Na2CO3; C2H5OH.
D. CuO; Cu(OH)2; C2H5OH; C6H6; CaCO3.
Câu 7. Cho sơ đồ sau:
CH2 = CH2 + H2O ![]() \(\overset{xt}{\rightarrow}\) X
\(\overset{xt}{\rightarrow}\) X
X + Y ![]() \(\overset{H_{2 } SO_{4},t^{\circ } }{\rightarrow}\) CH3COO-C2H5 + H2O
\(\overset{H_{2 } SO_{4},t^{\circ } }{\rightarrow}\) CH3COO-C2H5 + H2O
X + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Y + H2O
\(\overset{t^{\circ } }{\rightarrow}\) Y + H2O
Vậy X, Y có thể là:
A. C2H6, C2H5OH.
B. C2H5OH, CH3COONa.
C. C2H5OH, CH3COOH.
D. C2H4, C2H5OH.
Câu 8. Cặp chất tồn tại được trong một dung dịch là (không xảy ra phản ứng hóa học với nhau)
A. CH3COOH và NaOH.
B. CH3COOH và H3PO4.
C. CH3COOH và Ca(OH)2.
D. CH3COOH và Na2CO3.
Câu 9. Thủy phân chất béo trong môi trường axit thu được
A. glixerol và một số loại axit béo.
B. glixerol và một loại axit béo.
C. glixerol và một muối của axit béo.
D. glixerol và xà phòng
Câu 10. Aminoaxit (A) chứa 13,59% nitơ về khối lượng. Công thức phân tử của aminoaxit là
A. C3H7O2N.
B. C4H9O2N.
C. C5H11O2N.
D. C6H13O2N.
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm) Viết phương trình hóa học thực hiện sơ đồ chuyển đối hóa học sau:
C12H22O11 → C6H12O6 → C2H5OH →CH3COOH → CH3COOC2H5
Câu 2. (2 điểm) Bằng phương pháp hóa học hãy phân biệt các chất sau: C2H5OH, C6H12O6, C12H22O11 .
Câu 3. (2 điểm) Hỗn hợp A gồm metan và etilen. Đốt cháy hoàn toàn 2,24 lít hỗn hợp A (đktc) rồi cho sản phẩm đi qua bình đựng dung dịch Ba(OH)2 dư tạo ra 27,58 gam kết tủa.
a) Viết phương trình hóa học?
b) Tính thành phần, phần trăm thể tích hỗn hợp ban đầu
Đáp án đề kiểm tra học kì 2 môn Hóa học 9 - Đề số 2
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 7 | 8 | 9 | 10 |
| A | B | C | C | D | C | B | A | B |
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm)
(1) C12H22O11 + H2O ![]() \(\overset{men }{\rightarrow}\) C6H12O6 + C6H12O6
\(\overset{men }{\rightarrow}\) C6H12O6 + C6H12O6
(2) C6H12O6 ![]() \(\overset{men }{\rightarrow}\) 2C2H5OH + 2CO2
\(\overset{men }{\rightarrow}\) 2C2H5OH + 2CO2
(3) C2H5OH + O2 ![]() \(\overset{men }{\rightarrow}\) CH3COOH + H2O
\(\overset{men }{\rightarrow}\) CH3COOH + H2O
(4) CH3COOH(l) + C2H5OH(l) ![]() \(\overset{H_{2} SO_{4},t^{\circ } }{\rightleftharpoons}\)CH3COOC2H5(l) + H2O(l)
\(\overset{H_{2} SO_{4},t^{\circ } }{\rightleftharpoons}\)CH3COOC2H5(l) + H2O(l)
Câu 2. (2 điểm)
Trích mẫu thử ra ống nghiệm và đánh số thứ tự.
Cho các dung dịch trên tác dụng với dung dịch AgNO3 trong NH3, chất nào có phản ứng tráng bạc tạo thành kết tủa bạc là C6H12O6
C6H12O6(dd) + Ag2O(dd) ![]() \(\overset{NH_{3} }{\rightarrow}\) C6H12O7(dd) + 2Ag(r)
\(\overset{NH_{3} }{\rightarrow}\) C6H12O7(dd) + 2Ag(r)
Cho vài giọt dung dịch H2SO4 vào 2 dung dịch còn lại, đun nóng một thời gian rồi cho dung dịch AgNO3 trong NH3 vào, dung dịch có phản ứng tráng bạc là saccarozo
Câu 3. (2 điểm)
a) CH4 + 2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) CO2 + H2O
C2H4 + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
b) Gọi số mol của metan, etilen trong hỗn hợp là x, y (mol).
CH4 + 2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) CO2 + H2O
x mol x mol
C2H4 + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
y mol 2y mol
Dẫn sản phẩm đốt cháy đi qua Ba(OH)2 tạo kết tủa BaCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
(x + 2y) mol (x + 2y) mol
 \(\left\{ \begin{array}{l}
22,4(x + y) = 2,24\\
197(x + 2y) = 27,58
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,06mol\\
y = 0,04mol
\end{array} \right. = > \left\{ \begin{array}{l}
\% {V_{C{H_4}}} = \frac{{0,06 \times 22,4}}{{2,24}}.100\% = 60\% \\
\% {V_{{C_2}{H_4}}} = 100\% - 60\% = 40\%
\end{array} \right.\)
\(\left\{ \begin{array}{l}
22,4(x + y) = 2,24\\
197(x + 2y) = 27,58
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,06mol\\
y = 0,04mol
\end{array} \right. = > \left\{ \begin{array}{l}
\% {V_{C{H_4}}} = \frac{{0,06 \times 22,4}}{{2,24}}.100\% = 60\% \\
\% {V_{{C_2}{H_4}}} = 100\% - 60\% = 40\%
\end{array} \right.\)
Đề thi Hóa học kì 2 lớp 9 - Đề số 3
Phần 1: Trắc nghiệm (4 điểm)
Chọn và khoanh tròn vào chữ cái đứng trước phương án trả lời đúng:
Câu 1. Nhiệt độ sôi của rượu etylic là
- 78,3oC
- 7,3oC
- 73,5oC
- 73,7oC
Câu 2. Rượu etylic có khả năng hòa tan trong nước hơn metan, etilen là do
- trong phân tử rượu etylic có 2 nguyên tử cacbon.
- trong phân tử rượu etylic có 6 nguyên tử hiđro.
- trong phân tử rượu etylic có nhóm – OH.
- trong phân tử rượu etylic có 2 nguyên tử cacbon và 6 nguyên tử hiđro.
Câu 3. Chọn câu đúng trong các câu sau
- Những chất có nhóm –OH và nhóm –COOH tác dụng được với KOH.
- Những chất có nhóm –OH tác dụng được với K.
- Những chất có nhóm –COOH tác dụng với KOH nhưng không tác dụng với K.
- Những chất có nhóm –OH và nhóm –COOH cùng tác dụng với K và KOH.
Câu 4. Hãy chọn phương trình hoá học đúng khi đun một chất béo với nước có axit làm
xúc tác
- (RCOO)3C3H5 + 3H2O
 \(\overset{}{\rightarrow}\) C3H5(OH)3 + 3RCOOH
\(\overset{}{\rightarrow}\) C3H5(OH)3 + 3RCOOH - (RCOO)3C3H5 + 3H2O
 \(\overset{}{\rightarrow}\) 3C3H5OH + R(COOH)3
\(\overset{}{\rightarrow}\) 3C3H5OH + R(COOH)3 - 3RCOOC3H5 + 3H2O
 \(\overset{}{\rightarrow}\) 3C3H5OH + 3R-COOH
\(\overset{}{\rightarrow}\) 3C3H5OH + 3R-COOH - RCOO(C3H5)3 + 3H2O
 \(\overset{}{\rightarrow}\) 3C3H5OH + R-(COOH)3
\(\overset{}{\rightarrow}\) 3C3H5OH + R-(COOH)3
Câu 5. Ba gói bột màu trắng là glucozơ, tinh bột và saccarozơ. Có thể nhận biết bằng
cách nào sau đây?
- Dung dịch brom và Cu(OH)2.
- Dung dịch NaOH và dung dịch iot.
- Hoà tan vào nước và dung dịch HCl.
- Hoà tan vào nước và cho phản ứng với dung dịch AgNO3/NH3.
Câu 6. Cho hình vẽ mô tả thí nghiệm điều chế Cl2 từ MnO2 và HCl
Hóa chất lần lượt ở bình 1 và bình 2 là:
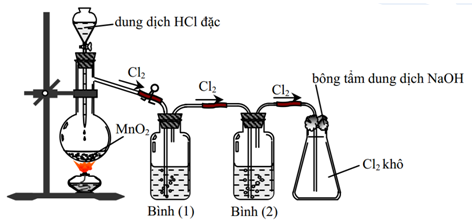
- Dung dịch NaCl bão hòa, dung dịch H2SO4 đặc
- Nước cất và dung dịch H2SO4 đặc
- Dung dịch H2SO4 đặc và dung dịch NaCl bão hòa
- Dung dịch H2SO4 đặc và nước cất
Câu 7. Phản ứng tráng gương là
- 2CH3COOH + Ba(OH)2
 \(\overset{}{\rightarrow}\) (CH3COO)2Ba + 2H2O.
\(\overset{}{\rightarrow}\) (CH3COO)2Ba + 2H2O. - C2H5OH + K
 \(\overset{}{\rightarrow}\) C2H5OK + H2
\(\overset{}{\rightarrow}\) C2H5OK + H2 - C6H12O6
 \(\overset{}{\rightarrow}\) 2C2H5OH + 2CO2
\(\overset{}{\rightarrow}\) 2C2H5OH + 2CO2 - C6H12O6 + Ag2O
 \(\overset{NH_{3} }{\rightarrow}\) C6H12O7 + 2Ag
\(\overset{NH_{3} }{\rightarrow}\) C6H12O7 + 2Ag
Câu 8. Loại tơ có nguồn gốc từ xenlulozơ là
- tơ tằm, bông vải.
- tơ tằm, sợi đay.
- bông vải, sợi đay.
- tơ tằm, tơ nilon-6,6.
Câu 9. Để thu được 1 tấn PVC thì khối lượng vinyl clorua cần dùng là (Hiệu suất phản ứng là 90%)
- 1 tấn
- 0,9 tấn
- 0,1 tấn
- 1,11 tấn
Câu 10. Biết 0,02 mol hiđrocacbon X có thể tác dụng tối đa với 100ml dung dịch brom 0,2M. Vậy X là
- C2H4
- CH4
- C2H2
- C2H6
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm) Hãy chọn chất thích hợp điền vào dấu (?) và hoàn thành các phương trình hóa học của các phản ứng hóa học sau:
- C2H5OH + ? → C2H5OK + ?
- C2H5OH
 \(\overset{H_{2} SO_{4} }{\rightarrow}\) ? + H2O
\(\overset{H_{2} SO_{4} }{\rightarrow}\) ? + H2O - ? + Na2CO3 → CH3COONa + CO2 + ?
- C11H22O11 + H2O
 \(\overset{}{\rightarrow}\) ? + ?
\(\overset{}{\rightarrow}\) ? + ?
Câu 2. (1 điểm) Chỉ dùng nước và một hóa chất khác, hãy phân biệt các chất sau.
Etyl axetat, ancol etylic, axit axetic
Câu 3. (3 điểm) Hỗn hợp X gồm ancol etylic và một rượu A có công thức phân tử là CnH2n+1OH. Cho 16,6 gam X tác dụng hết với Na thấy thoát ra 3,36 lít khí hidro (đktc).
a) Xác định công thức phân tử của rượu A.
b) Tính khối lượng rượu có mặt trong hỗn hợp X.
c) Viết công thức cấu tạo có thể có của rượu X.
(Na = 23, O = 16, C = 16, H = 1)
Đáp án đề kiểm tra học kì 2 môn Hóa học 9 - Đề số 3
Phần 1: Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | C | B | A | D | A | D | B | A | A |
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm)
a) C2H5OH + 2K → C2H5OK +H2
b) C2H5OH ![]() \(\overset{}{\rightarrow}\) CH2=CH2 + H2O
\(\overset{}{\rightarrow}\) CH2=CH2 + H2O
c) CH3COOH + Na2CO3 → CH3COONa + CO2 + H2O
d) C11H22O11 + H2O ![]() \(\overset{}{\rightarrow}\) C6H12O6 + C6H12O6
\(\overset{}{\rightarrow}\) C6H12O6 + C6H12O6
Câu 2. (1 điểm)
Trích mẫu thử ra ống nghiệm và đánh số thứ tự.
Cho các dung dịch trên tác dụng với nước: etyl axetat không tan trong nước, axit axetic và ancol etylic tan trong nước.
Dùng Na2CO3 để phân biệt axit axetic và ancol etylic: axit axetic giải phóng khí CO2.
Câu 3. (3 điểm)
a) Gọi số mol của C2H5OH và CnH2n+1OH lần lượt là x, y (mol).
CH3CH2OH + 2Na → 2CH3CH2ONa + H2
x mol 0,5x mol
CnH2n+1OH + 2Na → 2CH3CH2ONa + H2
y mol 0,5y mol
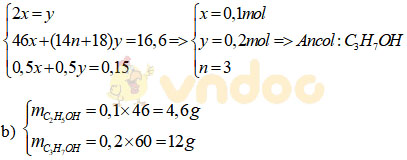
c) Công thức cấu tạo có thể có của X là: CH3CH2CH2OH, CH3CH(OH)CH3
Tài liệu vẫn còn, mời các bạn tải tài liệu về để xem đầy đủ nội dung bộ đề
Đề cương Hóa 9 học kì 2 năm 2020
10 Bộ đề thi Hóa học kì 2 lớp 9 năm 2020 - 2021 Có đáp án Chi tiết được VnDoc biên soạn, phù hợp nhiều trình độ, tổng hợp và trình bày khoa học các nội dung chính, quan trọng môn Hóa 9 trong chương trình học, kèm bài tập vận dụng bao gồm Trắc nghiệm và bài tập có lời văn để các em luyện tập thành thạo, không chỉ chuẩn bị tốt cho kì thi học kì 2 mà còn cho kỳ thi vào lớp 10 cũng như chắc kiến thức sang cấp học mới.
Link bài chi tiết: Đề cương ôn tập học kì 2 môn Hóa học lớp 9 năm 2019 - 2020
Ngoài Hóa10 Bộ đề thi Hóa học kì 2 lớp 9 năm 2020 - 2021 Có đáp án Chi tiết, các em học sinh lớp 9 còn có thể tham khảo Trắc nghiệm Hóa học 9 và đề thi học kì 2 lớp 9 của các môn Toán lớp 9, môn Vật Lý lớp 9 và Tiếng Anh lớp 9 mà VnDoc.com đã sưu tầm và chọn lọc. Hy vọng với những tài liệu này, các em học sinh sẽ học tốt môn Hóa học lớp 9 hơn.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.




