Lý thuyết Khoa học tự nhiên 7 bài 4 CTST
Lý thuyết KHTN lớp 7 bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Chân trời sáng tạo. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
A. Lý thuyết KHTN 7 bài 4
1.1. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
- Cơ sở chính để sắp xếp các nguyên tố hóa học vào bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) là dựa vào điện tích hạt nguyên tử.
- Nguyên tắc sắp xếp các nguyên tố hoá học trong bảng tuần hoàn:
+ Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử.
+ Các nguyên tố hoá học có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có tính chất hoá học tương tự nhau được xếp thành một cột.
1.2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
- Bảng tuần hoàn gồm các nguyên tố hoá học có cấu tạo gồm các ô nguyên tố, chu kì và nhóm.
- Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn (Hình 4.2).
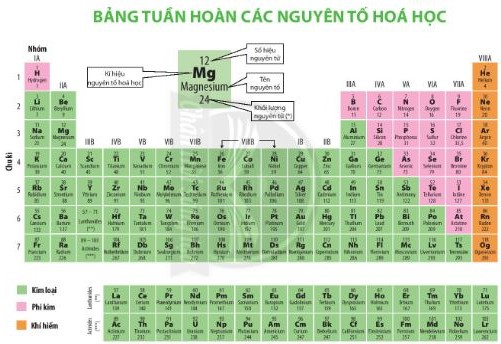
Hình 4.2. Bảng tuần hoàn các nguyên tố hóa học
a. Ô nguyên tố
- Mỗi ô nguyên tố cho biết các thông tin cần thiết về một nguyên tố hóa học:
+ Tên nguyên tố
+ Kí hiệu nguyên tố hóa học
+ Khối lượng nguyên tử
+ Số hiệu nguyên tử (là số thứ tự của nguyên tố trong bảng tuần hoàn)
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton trong hạt nhân = bằng số electron trong nguyên tử
Ví dụ: Nguyên tố hydrogen có số hiệu nguyên tử là 1. Suy ra nguyên tố hydrogen ở ô số 1 trong bảng tuần hoàn, điện tích hạt nhân là +1 (do có 1 proton trong hạt nhân) và có 1 electron trong nguyên tử.
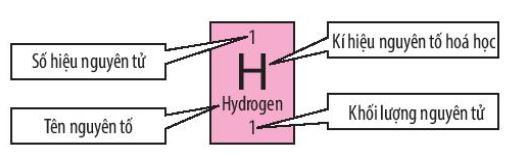
Hình 4.3. Các thông tin cơ bản trong một ô nguyên tố hóa học
b. Chu kì
- Chu kì là tập hợp các nguyên tố hoá học có cùng số lớp electron trong nguyên tử theo hàng ngang.
- Hiện nay, bảng tuần hoàn có tất cả 7 chu kì, chia làm hai loại chu kì (xét về số lượng các nguyên tố trong mỗi chu kì):
+ Chu kì nhỏ: các chu kì 1, 2, 3
+ Chu kì lớn: các chu kì 4, 5, 6, 7
Số thứ tự của chu kì = số lớp electron trong nguyên tử

Hình 4.4. Các chu kì nhỏ trong bảng tuần hoàn các nguyên tố hóa học
c. Nhóm
- Nhóm là tập hợp các nguyên tố hoá học theo cột dọc, có tính chất hoá học tương tự nhau và sắp xếp theo chiều tăng dần điện tích hạt nhân.
- Trong bảng tuần hoàn, các nhóm được kí hiệu bằng các chữ số La Mã (từ I đến VIII).

Hình 4.5. Một số nhóm nguyên tố trong bảng tuần hoàn
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (trừ H). Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li(+3) đến Fr(+87).
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (trừ At, Ts). Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ F(+9), đến Ts (+117).
1.3. Các nguyên tố kim loại
a. Các nguyên tố kim loại nhóm A
- Các nguyên tố kim loại nhóm A gồm: nhóm IA trừ nguyên tố hydrogen (được gọi nhóm kim loại kiềm), nhóm IIA (được gọi nhóm kim loại kiềm thổ), nhóm IIIA trừ nguyên tố boron,...

Hình 4.6. Một số kim loại nhóm IA

Hình 4.7. Một số kim loại nhóm IIA
b. Các nguyên tố kim loại nhóm B
- Các nguyên tố nhóm B đều là kim loại, mỗi nhóm B tương ứng với một cột trong bảng tuần hoàn (trừ nhóm VIIIB có 3 cột).
- Một số kim loại nhóm B có ứng dụng rộng rãi trong đời sống hằng ngày như: iron (Fe), copper (Cu), silver (Ag),...
1.4. Các nguyên tố phi kim
- Nhóm nguyên tố phi kim chủ yếu tập trung ở góc bên phải của bảng tuần hoàn các nguyên tố hóa học.
- Các nguyên tố phi kim bao gồm:
+ Nguyên tố hydrogen ở nhóm IA
+ Một số nguyên tố nhóm IIIA và IVA
+ Hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA (được gọi là nhóm nguyên tố halogen)
- Ở điều kiện thường, các phi kim có thể ở thể rắn, lỏng hoặc khí.
Ví dụ: Các đơn chất thuộc nhóm halogen có một số đặc điểm như: Có màu sắc đậm dần từ flourine tới iodine, thể thay đổi từ khí - lỏng - rắn, rất độc hại với các sinh vật.
1.5. Nhóm các nguyên tố khí hiếm
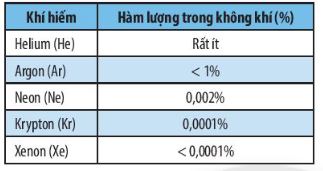
- Nhóm VIIIA gồm các nguyên tố khí hiếm: helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) và oganesson (Og).
- Ở điều kiện thường, các nguyên tố khí hiếm:
+ Là chất khí không màu (tồn tại dưới dạng đơn nguyên tử), tồn tại tự nhiên trong không khí với hàm lượng thấp
+ Rất kém hoạt động, hầu như không phản ứng với nhau và với các chất khác
- Các nguyên tố khí có một số ứng dụng quan trọng trong đời sống:
+ Trong công nghệ chế tạo bóng đèn. Các bóng đèn chứa xenon, argon và neon có thể phát ra ánh sáng với các màu sắc khác nhau.
+ Xenon được sử dụng để làm khi gây mê toàn phần; ứng dụng trong năng lượng hạt nhân; là tác nhân oxi hóa trong hóa học phân tích, ứng dụng trong tinh thể học protein.
Bảng 4.1. Hàm lượng các nguyên tố khí hiếm có trong không khí
|
1. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
2. Cấu tạo bảng tuần hoàn gồm: các ô nguyên tố, chu kì và nhóm.
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton trong hạt nhân = số electron trong nguyên tử
Số thứ tự của chu kì = số lớp electron trong nguyên tử
3. Hơn 80 % các nguyên tố hóa học trong bảng tuần hoàn là kim loại (gồm một số nguyên tố kim loại nhóm A và tất cả các nguyên tố kim loại nhóm B). 4. Các nguyên tố phi kim bao gồm: nguyên tố hydrogen ở nhóm IA, một số nguyên tố nhóm IIIA và IVA, hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA. 5. Nhóm VIIIA gồm các nguyên tố khí hiếm. Ở điều kiện thường, các nguyên tố khí hiếm là chất khí không màu, tồn tại tự nhiên trong không khí với hàm lượng thấp, rất kém hoạt động, hầu như không phản ứng với nhau và với các chất khác. |
B. Bài tập minh họa
Bài 1: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ nhận ra tính chất của chúng không?
Hướng dẫn giải
- Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân
+ Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử
+ Các nguyên tố trong cùng cột có tính chất gần giống nhau
Bài 2: Quan sát bảng tuần hoàn, ô nguyên tố số 11 và cho biết:
a) Tên nguyên tố, kí hiệu nguyên tố hóa học, khối lượng nguyên tử, số hiệu nguyên tử
b) Số proton, số electron và số lớp electron
c) Những nguyên tố nào trong bảng tuần hoàn có tính chất hóa học tương tự nguyên tố trên
Hướng dẫn giải
a) Ô nguyên tố số 11 là nguyên tố sodium (Na), khối lượng nguyên tử bằng 23, số hiệu nguyên tử bằng 11
b) Số hiệu nguyên tử = số proton = số electron = 11
Số lớp electron = số thứ tự chu kì = 3
Nguyên tố sodium (Na) có 11 proton trong hạt nhân, 11 electron và có 3 lớp electron trong nguyên tử
c) Những nguyên tố kim loại thuộc nhóm IA có tính chất tương tự nguyên tố Na (vì nguyên tố Na là nguyên tố kim loại thuộc nhóm IA): Li, K, Rb, Cs, Fr
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học CTST trên đây các bạn có thể tham khảo Toán lớp 7 tập 1 Chân trời sáng tạo và Ngữ Văn 7 Tập 1 Chân trời sáng tạo, Công Nghệ 7 CTST,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.







