Lý thuyết Khoa học tự nhiên 7 bài 6 CTST
Lý thuyết Khoa học tự nhiên lớp 7 – Bài 6: Giới thiệu về liên kết hóa học gồm hệ thống câu hỏi lý thuyết và trắc nghiệm có đáp án chi tiết, giúp các em dễ dàng ôn tập, củng cố kiến thức và rèn luyện kỹ năng vận dụng. Với cách trình bày rõ ràng, dễ hiểu, bài học hỗ trợ học sinh hiểu sâu hơn về bản chất của liên kết hóa học, từ đó tạo nền tảng vững chắc cho việc học các nội dung Hóa học ở các lớp tiếp theo. Mời các bạn tham khảo để học tốt môn Khoa học tự nhiên 7 sách Chân trời sáng tạo.
Bài: Giới thiệu về liên kết hóa học
A. Lý thuyết KHTN 7 bài 6
1.1. Vỏ nguyên tử khí hiếm
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hoá học kém, gồm: helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), ...
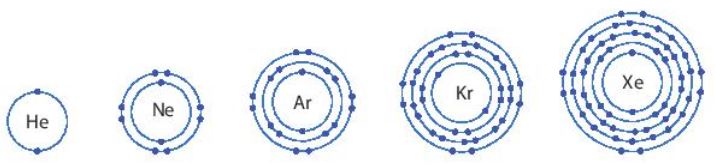
Hình 6.1. Hình mô phỏng vỏ nguyên tử của một số nguyên tố khí hiếm
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
1.2. Liên kết ion
a. Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương (Hình 6.2).
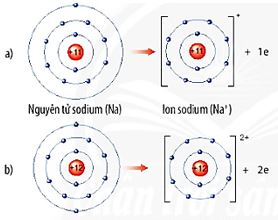
Hình 6.2. Sơ đồ tạo thành ion dương của sodium (a) và magnesium (b)
b. Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim (Cl, O, N, ...) có số electron lớp ngoài cùng là 7, 6, 5,...
- Khi kết hợp với các nguyên tử kim loại, nguyên tử phi kim có xu hướng nhận electron từ nguyên tử kim loại để có lớp ngoài cũng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng (Hình 6.3).
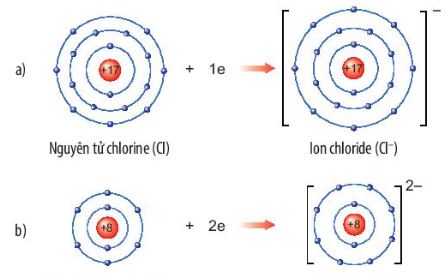
Hình 6.3. Sơ đồ tạo thành ion âm của chlorine (a) và oxygen (b)
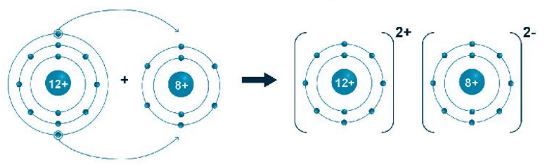
c. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên tử kim loại nhường electron tạo thành ion dương, đồng thời nguyên tử phi kim nhận electron tạo thành ion âm.
- lon dương và ion âm mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion.
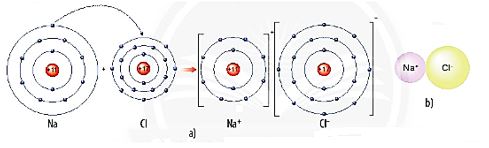
Hình 6.4. a) Sơ đồ tạo thành liên kết ion trong phân tử sodium chloride.
b) Hình mô phỏng phân tử sodium chloride
1.3. Liên kết cộng hóa trị
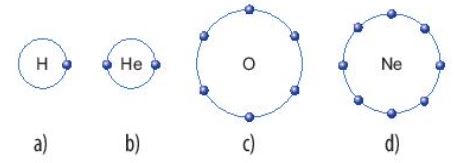
Hình 6.5. Lớp electron ngoài cùng của nguyên tử hydrogen (a),
helium (b), oxygen (c), neon (d)
- Để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất, các nguyên tử của nguyên tố phi kim có xu hướng góp chung electron.
- Sau khi hình thành liên kết, số electron của mỗi nguyên tử được xác định bằng tổng số electron dùng chung giữa các nguyên tử và số electron còn lại của mỗi nguyên tử.
- Liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử được gọi là l iên kết cộng hóa trị.
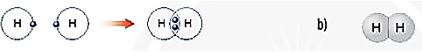
Hình 6.6. a) Sơ đồ tạo thành liên kết cộng hóa trị trong phân tử hydrogen
b) Hình mô phỏng phân tử hydrogen
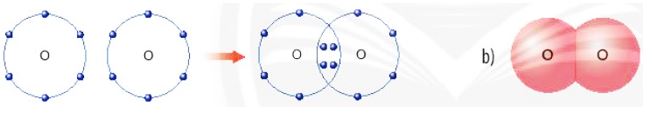
Hình 6.7. a) Sơ đồ tạo thành liên kết cộng hóa trị trong phân tử oxygen
b) Hình mô phỏng phân tử oxygen
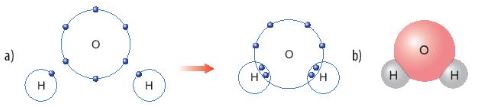
Hình 6.8. a) Sơ đồ tạo thành liên kết cộng hóa trị trong phân tử nước
b) Hình mô phỏng phân tử nước
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim.
Ví dụ: Phân tử khí hydrogen có liên kết cộng hóa trị giữa 2 nguyên tử H; phân tử khí oxygen có liên kết cộng hóa trị giữa 2 nguyên tử O; ...Phân tử nước có liên kết cộng hóa trị giữa nguyên tử hydrogen và oxygen; phân tử carbon dioxide có liên kết cộng hóa trị giữa nguyên tử carbon và oxygen; phân tử ammonia có liên kết cộng hóa trị giữa nguyên tử nitrogen và hydrogen; ...
1.4. Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
Ví dụ: Các phân tử như sodium chloride, calcium chloride, magnesium oxide,... được hình thành bằng liên kết ion.

Hình 6.9. Một số hợp chất ion
- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
Ví dụ: Những chất như khí hydrogen, khí ammonia, nước, đường tinh luyện (saccharose), ethanol, khí carbon dioxide được hình thành bằng liên kết cộng hóa trị.

Hình 6.10. Một số hợp chất cộng hóa trị
1.5. Một số tính chất của chất ion và chất cộng hóa trị
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện.
- Chất cộng hóa trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hoá trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
|
1. Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron. 2. Liên kết ion là liên kết giữa ion dương và ion âm. Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm. 3. Liên kết cộng hoá trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử. Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim 4. C hất ion là chất được tạo bởi các ion dương và ion âm. Ở điều kiện thường, chất ion thường ở thể rắn. Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện. 5. C hất cộng hóa trị là c hất được tạo thành nhờ liên kết cộng hoá trị. Ở điều kiện thường, chất cộng hóa trị có thể ở thể rắn, lỏng hoặc khí. Chất cộng hóa trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện. |
B. Bài tập minh họa
Bài 1: Magnesium oxide (gồm 1 nguyên tử magnesium và 1 nguyên tử oxygen) có nhiều ứng dụng trong đời sống. Nó là thành phần chính trong các lò sản xuất sắt, thép, các kim loại màu, thủy tinh hay xi măng,… Em hãy cho biết thêm các ứng dụng khác của magnesium oxide. Vẽ sơ đồ hình thành phân tử magnesium oxide và tính khối lượng phân tử của nó.

Hướng dẫn giải:
- Các ứng dụng khác của magnesium oxide:
+ Xử lý nước thải, nước sinh hoạt, xử lý đất, xử lý nước ngầm,… để ổn định pH.
+ Giúp cơ thể cải thiện chứng khó tiêu, ổn định acid trong dạ dày,…
+ Dùng làm lõi cửa chống cháy,…
- Sự hình thành phân tử magnesium oxide:
+ Nguyên tử của nguyên tố magnesium nhường 2 electron lớp ngoài cùng để tạo thành ion dương có 8 electron lớp ngoài cùng bền vững.
+ Nguyên tử của nguyên tố oxygen nhận 2 electron để tạo ion âm có 8 electron lớp ngoài cùng bền vững.
+ Hai ion trái dấu hút nhau bằng lực hút tĩnh điện và tạo thành liên kết ion
- Phân tử magnesium oxide được tạo bởi một nguyên tử của nguyên tố Mg và một nguyên tử của nguyên tố O
=> Khối lượng phân tử magnesium oxide là: 24.1+ 16.1 = 40 (amu)
Bài 2: Trong quả nho chín có chứa nhiều glucose. Phân tử glucose gồm có 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen. Theo em, trong phân tử glucose có liên kết ion hay liên kết cộng hóa trị? Giải thích và tính khối lượng phân tử glucose.
Hướng dẫn giải
- Phân tử glucose được tạo bởi nguyên tử của các nguyên tố C, H, O, là những nguyên tử của nguyên tố phi kim nên liên kết trong phân tử này là liên kết cộng hóa trị.
=> Glucose là chất cộng hóa trị
- Phân tử glucose gồm 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen
=> Khối lượng phân tử glucose là: 6.12 + 12.1 + 6.16 = 180 (amu).
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 6: Giới thiệu về liên kết hóa học CTST trên đây các bạn có thể tham khảo Toán lớp 7 tập 1 Chân trời sáng tạo và Ngữ Văn 7 Tập 1 Chân trời sáng tạo, Công Nghệ 7 CTST,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.