Xác định biểu thức hằng số cân bằng Kc của phản ứng
Cho phản ứng hóa học sau: I2(g) + H2(g) 2HI(g)
Biểu thức hằng số cân bằng (KC) của phản ứng trên là:
Phản ứng hóa học sau: I2(g) + H2(g) 2HI(g)
Biểu thức hằng số cân bằng (KC):
Vndoc.com xin gửi tới bạn đọc Đề thi cuối học kì 1 môn Hóa 11, cùng nhau luyện tập và xem kết quả nha!
Xác định biểu thức hằng số cân bằng Kc của phản ứng
Cho phản ứng hóa học sau: I2(g) + H2(g) 2HI(g)
Biểu thức hằng số cân bằng (KC) của phản ứng trên là:
Phản ứng hóa học sau: I2(g) + H2(g) 2HI(g)
Biểu thức hằng số cân bằng (KC):
Nhận định đúng về nitric acid
Nội dung nào sau đây đúng khi nói về nitric acid?
Dung dịch nitric acid tinh khiết là chất lỏng không màu.
Nitric acid tinh khiết kém bền, bị phân hủy một phần giải phóng khí nitrogen dioxide ngay ở điều kiện thường khi có ánh sáng.
Nitric acid có tính oxi hóa mạnh có thể ăn mòn được hầu hết kim loại trừ Au và Pt
Nitric acid là một acid mạnh, trong dung dịch loãng phân li hoàn toàn.
Biện pháp không thể hạn chế được hiện tượng phú dưỡng
Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa dinh dưỡng đã cung cấp nguồn thức ăn cho sinh vật phù du phát triển mạnh. Biện pháp nào sau đây không thể hạn chế được hiện tượng phú dưỡng?
Bổ sung thêm phân bón chứa nhiều ion NO3- càng làm tăng hàm lượng các nguyên tố dinh dưỡng (N) nên không thể hạn chế được hiện tượng phú dưỡng.
Xác định phương pháp khi tách và tinh chế các chất
Khi tách và tinh chế các chất từ hỗn hợp dựa trên độ hòa tan khác nhau của các chất đó trong hai môi trường không hòa tan vào nhau, người ta thường sử dụng phương pháp nào sau đây?
Chiết là phương pháp tách biệt và tinh chế hỗn hợp các chất dựa vào sự hòa tan khác nhau của chúng trong hai môi trường không trộn lẫn vào nhau.
Tính hiệu suất tổng hợp NH3
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương úng là 1:3. Nung nóng X trong bình kín (450 °C, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
- Giả sử số mol ban đầu của N2 là 1 mol, của H2 là 3 mol.
⇒ Tổng số mol khí ban đầu là 4 mol.
N2(g) + 3H2(g) 2NH3(g)
Ban đầu: 1 3 (mol)
Phản ứng: x 3x 2x (mol)
Cân bằng: 1 − x 3 − 3x 2x (mol)
⇒ Tổng số mol khí sau khi phản ứng là: 1 − x + 3 − 3x + 2x = 4 − 2x
- Số mol khí giảm so với ban đầu là 2x mol.
Hỗn hợp khí có số mol giảm đi 5% so với ban đầu nên: 2x = 5% × 4 ⇒ x = 0,1.
⇒ Hiệu suất của phản ứng là:
Xác định dãy gồm các chất điện li yếu
Dãy gồm các chất đều là chất điện li yếu là
Chất điện li yếu là chất phân li một phần trong nước.
Các chất điện li yếu là: H2S, H3PO4, CH3COOH, Cu(OH)2.
Số cặp chất là đồng đẳng của nhau
Trong các dãy chất sau đây, có mấy dãy gồm các chất là đồng đẳng của nhau?
(1) C2H6, CH4, C4H10;
(2) C2H5OH, CH3CH2CH2OH
(3) CH3OCH3, CH3CH2OH;
(4) CH3COOH, HCOOH, C2H3COOH.
Các chất là đồng đẳng của nhau
(1) C2H6, CH4, C4H10;
(2) C2H5OH, CH3CH2CH2OH
(1); (2) gồm các chất có cấu tạo tương tự nhau, thành phần phân tử hơn kém nhau 1 nhóm –CH2 nên là đồng đẳng của nhau.
Xác định nhóm chức
Cho hợp chất hữu cơ sau: CH3-NH-CH2-CH3. Nhóm chức trong hợp chất trên là:
Nhóm chức trong hợp chất trên là Amine bậc II
CH3-NH-CH2-CH3.
Công thức đơn giản nhất của glucose
Glucose là hợp chất hữu cơ có nhiều trong các loại quả chín, đặc biệt là quả nho. Công thức phân tử của glucose là C6H12O6. Công thức đơn giản nhất của glucose là.
Công thức đơn giản nhất của glucose là CH2O.
Dãy kim loại phản ứng H2SO4 đặc nguội
Dãy kim loại nào sau đây đều gồm các kim loại phản ứng với H2SO4 đặc nguội là?
Fe và Al bị thụ động hóa trong H2SO4 đặc nguội.
Vậy Zn, Mg, Cu tác dụng được H2SO4 đặc nguội
Cấu tạo phân tử nitrogen
Phân tử nitrogen có cấu tạo là:
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba.
N ≡ N.
Xác định công thức biểu diễn đúng cấu tạo của chất
Công thức nào dưới đây biểu diễn đúng cấu tạo hoá học của chất?
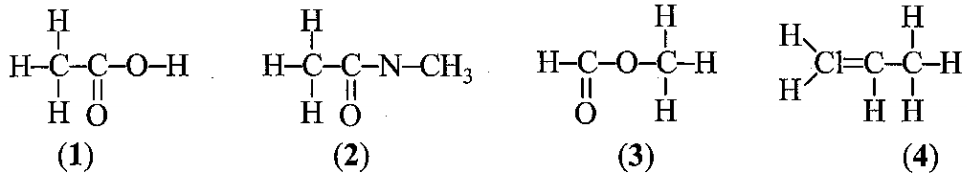
Công thức biểu diễn đúng cấu tạo hoá học của chất là: (1); (3)
Giải thích: Trong hợp chất hữu cơ, C mang hoá trị IV, N mang hóa trị III và Cl mang hóa trị I.
Xác định phản ứng thuận nghịch
Phản ứng nào sau đây là phản ứng thuận nghịch?
Phản ứng thuận nghịch được biểu diễn bằng mũi tên hai chiều "⇌".
⇒ Phản ứng thuận nghịch là: N2(g) + 3H2(g) ⇌ 2NH3(g).
Xác định môi trường của dung dịch
Một dung dịch có [OH-] = 2,5.10-10M. Môi trường của dung dịch là:
Ta có: [OH-] = 2,5.10-10M
pH = 14 − (−log[OH−]) = 14 − 9,6 = 4,4 < 7
Vậy dung dịch có môi trường acid.
Chọn nội dung sai khi nói về nitrogen
Chọn nội dung sai khi nói về nitrogen.
Trong tự nhiên, nitrogen tồn tại cả ở dạng đơn chất và hợp chất.
- Trong khí quyển, nguyên tố nitrogen tồn tại chủ yếu dưới dạng đơn chất, N2.
- Trong đất và nước, nitrogen tồn tại chủ yếu dưới dạng ion nitrate (NO3-), nitrate (NO2-) ammonium (NH4+).
Nồng độ mol/l của dung dịch Ba(OH)2
Cho 3,4706 lít khí SO2 (đkc) hấp thụ hết trong 2,5 lít dung dịch Ba(OH)2 thu được 13,02 gam kết tủa. Nồng độ mol/L của dung dịch Ba(OH)2 là
nSO2 = 0,14 mol;
nBaSO3 = 0,06 mol
nBaSO3 < nSO2
⇒ Phản ứng sinh ra 2 muối BaSO3 và Ba(HSO3)2
Bảo toàn nguyên tố S:
nSO2 = nBaSO3 + 2.nBa(HSO3)2
⇒ nBa(HSO3)2 = (0,14 - 0,06) : 2 = 0,04 mol
Bảo toàn nguyên tố Ba:
nBa(OH)2 = nBaSO3 + nBa(HSO3)2 = 0,06 + 0,04 = 0,1 mol.
⇒ CMBa(OH)2 = 0,1:2,5 = 0,04 M
NH3 dư vào dung dịch thu được kết tủa
Dẫn khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
CuCl2 và NaNO3 không phản ứng với NH3.
AlCl3 và CuCl2 phản ứng với NH3 theo phương trình:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
CuCl2 + 2NH3 + 2H2O → Cu(OH)2 ↓ + 2NH4Cl
Khi NH3 dư:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (tan)
Vậy dẫn khí NH3 đến dư vào dung dịch AlCl3 để thu được kết tủa.
Sulfur đơn chất đóng vai trò chất khử
Cho các phản ứng sau:
a) S + O2 SO2.
b) Hg + S → HgS.
c) S + 6HNO3 → H2SO4 + 6NO2 + 2H2O.
d) Fe + S FeS.
e) H2 + S8 → H2S.
Số phản ứng trong đó sulfur đơn chất đóng vai trò chất khử là:
Phản ứng trong đó sulfur đóng vai trò là chất khử là: (a); (c).
a) S0 + O2 S+4O2.
c) S0 + 6HNO3 → H2S+6O4 + 6NO2 + 2H2O.
Xác định chất điện li
Chất nào sau đây là chất điện li?
Chất điện li là chất khi tan trong nước phân li thành các ion.
Chất điện li là KNO3, phương trình điện li:
KNO3 → K+ + NO3-
Tính tỉ lệ thể tích dung dịch HCl cần dùng để pha trộn
Tính tỉ lệ thể tích của dung dịch HCl có pH = 1 và dung dịch HCl pH = 4 cần dùng để pha trộn thành dung dịch có pH = 3.
Dung dịch sau khi trộn pH = 3 ⇒ môi trường acid.
Xác định x
Trong công nghiệp, hydrogen được sản xuất từ phản ứng sau:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
Ở 760oC, giả sử ban đầu chỉ có CH4 và H2O với nồng độ bằng nhau và bằng x mol. Xác định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M và hằng số cân bằng KC = 6,285.
Ta có:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
Ban đầu: x x 0 0 M
Phản ứng: 0,2 0,2 0,6 0,2 M
Cân bằng: (x – 0,2) (x – 0,2) 0,6 0,2 M
Do giá trị KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Nên:
⇒ 0,0432 = 6,285x2 – 2,514x + 0,2514
⇒ 6,285x2 – 2,514x + 0,2082 = 0
⇒ x = 0,283 (thoả mãn); x = 0,12 (loại do 0,12 < 0,2).
Tính khối lượng phân đạm được sản xuất
Trong công nghiệp, nitric acid được dùng để sản xuất phân bón hóa học:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Giả sử từ 1 m3 dung dịch HNO3 63% (khối lượng riêng 1,25 g/mL), tính khối lượng phân đạm chứa 60% Ca(NO3)2 được sản xuất theo phương trình trên.
1 m3 = 106 ml
⇒ mdd HNO3 = 1,25.106 gam
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
mol: 12500 → 6250
mCa(NO3)2 = 6250.164 = 1025000 (g)
Khối lượng phân đạm chứa 60% Ca(NO3)2 được sản xuất là:
m phân đạm = = 1708333 (g)
1,7 tấn
Phổ hồng ngoại của hợp chất hữu cơ
Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không có hấp thụ ở vùng 1 750 - 1 600 cm−1?
Phổ hồng ngoại của hợp chất hữu cơ không có hấp thụ ở vùng 1750 - 1600 cm−1: alcohol
Thành phần chính của quặng pyrite
Trong tự nhiên sulfur tồn tại ở dạng đơn chất và hợp chất. Thành phần chính của quặng pyrite là hợp chất nào sau đây?
Thành phần chính của quặng pyrite là FeS2.
Acid chủ yếu gây mưa acid
Acid chủ yếu gây mưa acid là
Acid chủ yếu gây mưa acid là H2SO4, HNO3.
Xác định công thức phân tử của A
Phân tích chất hữu cơ A chứa C, H, O ta có kết quả sau: mC: mH : mO = 2,25 : 0,375 : 2. Xác định công thức phân tử của A, biết tỉ khối của A so với Hydrogen là 37.
Phân tích định lượng ta được khối lượng các nguyên tố trong phân tử:
Công thức đơn giản nhất của hợp chất A là (C3H6O2)n
Biết tỉ khối của A so với Hydrogen là 37
⇒ M = 37.2 = 74 ⇒ n = 1.
Vậy công thức phân tử của A là C3H6O2
Tính thể tích khí CO
Hòa tan 75,6 gam hỗn hợp A gồm Fe, FeO, Fe3O4, Cu và CuO bằng dung dịch H2SO4 dư thu được 13,015 lít khí SO2 (đkc, sản phẩm khử duy nhất) và dung dịch B chứa 198 gam hai muối sulfate. Mặt khác khử hoàn toàn hỗn hợp A cần dùng V lít khí CO (đktc). Giá trị của V là
Quy đổi hỗn hợp A gồm Fe, Cu và O với số mol lần lượt là x, y, z mol
⇒ mhỗn hợp A = 56x + 64y + 16z = 75,6 (1)
nSO2 = 13,015 : 24,79 = 0,525 mol
Xét quá trình nhường – nhận e:
Fe0 → Fe+3 + 3e x → 3x Cu0 → Cu+2 + 2e. y → 2y | S+6 + 2e → S+4 0,525 → 1,05 O0 + 2e → O-2 z → 2z |
Áp dụng định luật bảo toàn electron ta có:
Σne nhường = Σne nhận
⇒ 3x + 2y = 1,05 + 2x
⇔ 3x + 2y - 2z = 1,05 (2)
Dung dịch B chứa 198 gam hai muối sulfate gồm: Fe2(SO4)3 (x/2 mol); và CuSO4 (y mol)
⇒ 400. + 160y = 198 (3)
Từ (1), (2) và (3) giải hệ phương trình
⇒ x = 0,75; y = 0,3; z = 0,9
Khử hỗn hợp A bằng CO ta có phản ứng:
CO + [O] → CO2
0,9 ← 0,9 mol
⇒ VCO = 0,9.24,79 = 22,311 (lít)
Nội dung thuyết Brønsted - Lowry
Năm 1923, Brønsted và Lowry đã đề xuất thuyết về acid và base có nội dung là gì?
Năm 1923, Bonsted và Lowry đã đề xuất thuyết về acid và base như sau: Acid là những chất có khả năng cho H+, Base là những chất có khả năng nhận H+.
Yếu tố không ảnh hưởng đến cân bằng hóa học
Yếu tố nào sau đây không ảnh hưởng đến sự chuyển dịch cân bằng hóa học?
Chất xúc tác làm tăng đồng thời tốc độ phản ứng thuận và phản ứng nghịch như nhau, do đó không làm chuyển dịch cân bằng hóa học.
Muối sulfate được sử dụng làm phân bón
Muối nào sau đây được sử dụng làm phân bón.
Ammonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón, cung cấp đạm cho đất.
Công thức phân tử của Z
Hợp chất Z có công thức đơn giản nhất là CH2Cl và có tỉ khối hơi so với hydrogen bằng 49,5. Công thức phân tử của Z là
Gọi công thức đơn giản nhất của hợp chất hữu cơ là (CH2Cl)n
Ta có:
dZ/H = 49,5 ⇒ MZ = 49,5. 2 = 99
⇒ M(CH2Cl)n = 99
⇒ 46,5n = 99 ⇒ n = 2.
Vậy công thức phân tử của Z là C2H4Cl2.
Khối lượng dung dịch thu được sau phản ứng
Cho 2,208 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 1,4874 lít khí H2 (ở đkc). Khối lượng dung dịch thu được sau phản ứng là:
Ta có: nH2SO4 = nH2 = 1,4874 : 24,79 = 0,06 mol
→ mH2SO4 = 0,06.98 = 5,88 gam
→ mdd H2SO4 = (5,88.100):10 = 58,8 gam
Áp dụng định luật bảo toàn khối lượng:
mhỗn hợp KL + mdd H2SO4 = mdd sau phản ứng + mH2
→ mdd sau phản ứng = mhỗn hợp KL + mdd H2SO4 - mH2 = 2,208 + 58,8 – 0,06. 2 = 61,128 gam
Phản ứng khởi đầu cho quá trình tạo ion nitrate
Trong khí quyển, phản ứng khởi đầu cho quá trình tạo ion nitrate là
Trong khí quyển, phản ứng N2 + O2 2NO chính là sự khởi đầu cho quá trình tạo thành ion nitrate (NO3-), được coi là một nguồn ung cấp đạm cho đất.
Hợp chất thuộc loại Hydrocarbon
Cho các chất sau đây: CH4, NH4Cl, CO2, C2H4, C6H6. Số hợp chất thuộc loại Hydrocarbon là:
Số hợp chất thuộc loại Hydrocarbon là 3 đó là: CH4, C2H4, C6H6
Chọn thuốc thử nhận biết các dung dịch
Cho các dung dịch (NH4)2SO4, (NH4)2CO3, NaOH và dung dịch NH3 loãng. Chọn thuốc thử để nhận biết các dung dịch trên?
Dùng dung dịch AlCl3: Nhỏ lần lượt tới dư các mẫu thử vào AlCl3.
- Có kết tủa keo trắng là NH3.
- Có kết tủa keo trắng sau đó tan là NaOH.
- Có kết tủa keo trắng và khí không màu là (NH4)2CO3.
- Còn là không hiện tượng là (NH4)2SO4.
Đồng phân của nhau
Cặp chất nào sau đây là đồng phân của nhau?
Xét bảng sau:
|
Công thức cấu tạo |
Công thức phân tử |
|
C2H5COOH |
C3H6O2 |
|
HCOOC2H5 |
C3H6O2 |
|
HCOOH |
CH2O2 |
|
CH3OH |
CH4O |
|
C2H5OH |
C2H6O |
|
CH3OCH2CH3 |
C3H8O |
Vì C2H5COOH và HCOOC2H5 đều có công thức phân tử là C3H6O2 nên C2H5COOH và HCOOC2H5 là đồng phân của nhau.
H2SO4 đóng vai trò chất oxi hóa
Cho dung dịch H2SO4 đặc tác dụng với từng chất sau: Fe(OH)2, NaBr, NaI, Fe2O3 ở nhiệt độ thích hơp. Số phản ứng trong đó H2SO4 đóng vai trò chất oxi hóa là:
Phương trình phản ứng minh họa các đáp án
2NaBr-1 + 2H2S+6O4 → 0Br2 + S+4O2 + 2H2O + Na2SO4
2NaI-1 + 2H2S+6O4 → 0I2 + S+4O2 + 2H2O + Na2SO4
2Fe+2(OH)2 + 4H2S+6O4 → Fe2(SO4)3 + SO2↑ + 6H2O.
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Số phản ứng trong đó H2SO4 đóng vai trò chất oxi hóa là 3
Ứng dụng phương pháp nào để ngâm rượu thuốc
Phương pháp nào sau đây được ứng dụng để ngâm rượu thuốc?
Áp dụng phương pháp chiết lỏng - rắn để tách lấy chất hữu cơ ra khỏi một hỗn hợp ở thể rắn, thường được áp dụng để nâm rượu thuốc, phân tích thổ nhưỡng, phân tích dư lượng thuốc bảo vệ thực vật trong nông sản,...
Xác định nồng độ mol của dung dịch HCl
Chuẩn độ 40 ml dung dịch HCl chưa biết nồng độ đã dùng hết 25 ml dung dịch NaOH 0,2 M. Xác định nồng độ mol của dung dịch HCl.
Phương trình:
HCl + NaOH → NaCl + H2O
nNaOH = 0,025.0,2 = 0,005 (mol)
Theo phương trình:
nHCl = nNaOH = 0,005 (mol)
Nồng độ mol của dung dịch HCl là:
0,005/0,05 = 0,125 (M)
Thể tích khí SO2 (đkc)
Dẫn khí SO2 vào 200 mL dung dịch KMnO4 0,02 M đến khi mất màu tím theo sơ đồ phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Thể tích khí SO2 (đkc) đã phản ứng là:
Phương trình hoá học:
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4.
10.10-3 ← 4.10-3
nKMnO4 = 4.10-3 mol
⇒ nSO2 = 10.10-3 mol
⇒ VSO2 = nSO2 . 24,79 = 10.10-3 . 24,79 = 0,2479 L = 247,9 mL
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

