Hydrocarbon không no
Hydrocarbon không no là hydrocarbon trong phân tử có liên kết đôi (C=C) hoặc liên kết ba (C![]() \(\equiv\)C) (gọi chung là liên kết bội) hoặc cả hai loại liên kết đó.
\(\equiv\)C) (gọi chung là liên kết bội) hoặc cả hai loại liên kết đó.
Ví dụ: Các alkene, alkyne, alkadiene,...
Alkene là hydrocarbon không no, mạch hở, phân tử có một liên kết đôi (C=C) trong phân tử.
Công thức chung của alkene là CnH2n (n ≥ 2).
Ví dụ: Ethene (CH2=CH2); propene (CH2=CH-CH3)
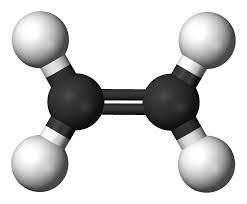
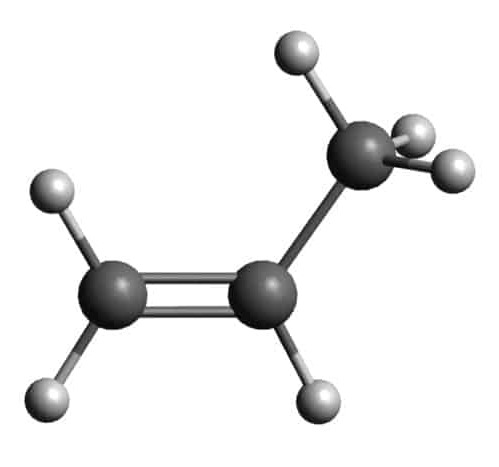
Mô hình phân tử ethyne và propene
Alkyne là hydrocarbon không no, mạch hở, phân tử có một liên kết ba (C![]() \(\equiv\)C) trong phân tử.
\(\equiv\)C) trong phân tử.
Công thức chung của alkyne là CnH2n-2 (n ≥ 2).
Ví dụ: Ethyne (C![]() \(\equiv\)C); propyne (CH
\(\equiv\)C); propyne (CH![]() \(\equiv\)C-CH3)
\(\equiv\)C-CH3)

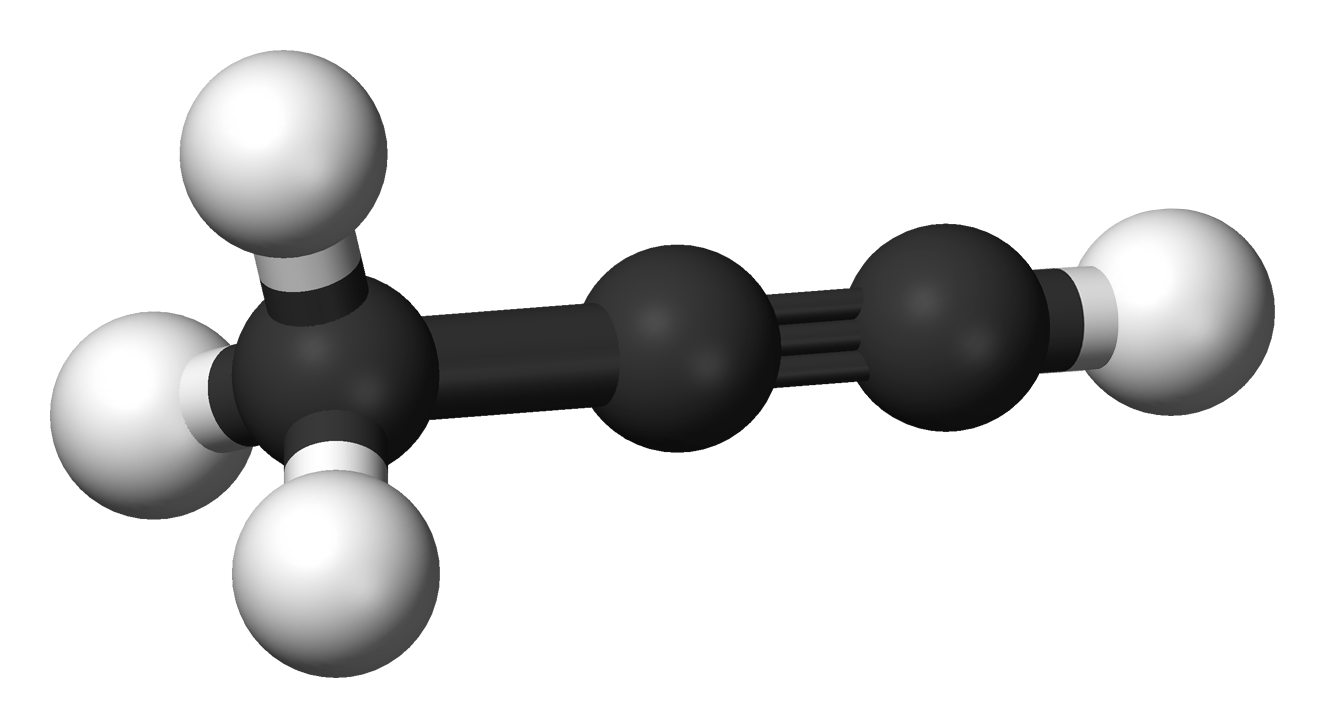
Mô hình phân tử của ethyne và propyne
2. Đồng phân
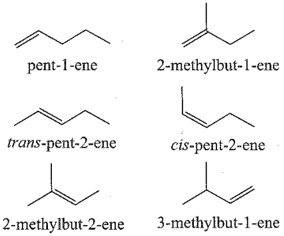
Alkene và alkyne có đồng phân cấu tạo gồm đồng phân về vị trí liên kết bội và đồng phân mạch carbon.
Ví dụ: Alkene C4H8 có 3 đồng phân cấu tạo
![]()
![]()
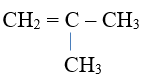
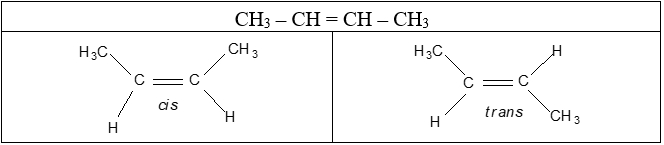
Alkene còn có đồng phân hình học khi mỗi nguyên tử carbon ở liên kết đôi liên kết với các nguyên tử/ nhóm nguyên tử khác nhau.
- Nếu mạch chính nằm ở một phía của liên kết đôi, gọi là đồng phân hình học dạng cis-.
- Nếu mạch chính nằm về hai phía khác nhau của liên kết đôi, gọi là đồng phân hình học dạng trans-.
Ví dụ: Phân tử but-2-ene (CH3-CH=CH-CH3) có hai đồng phân hình học dạng cis- và trans-
3. Danh pháp
Tên thay thế của alkene hay alkyne gồm hai phần: phần tiền tố cho biết số lượng nguyên tử carbon trong mạch carbon (eth-, pro-, but-,... ), phần hậu tố là -ene (đối với alkene) hay -yne (đối với alkyne).
Ví dụ:
CH3-CH3 CH2=CH2 CH![]() \(\equiv\)CH
\(\equiv\)CH
ethane ethene ethyne
CH3-CH2-CH3 CH3-CH=CH2 CH3-C![]() \(\equiv\)CH
\(\equiv\)CH
propane propene propyne
Khi mạch carbon dài hơn cần thêm số chỉ vị trí liên kết bội trong mạch carbon vào ngay phía trước hậu tố -ene (khi gọi tên alkene) hay -yne (khi gọi tên alkyne). Mạch carbon được đánh số từ phía gần liên kết bội hơn.
- Tên của alkene và alkyne mạch không phân nhánh:

- Tên của alkene, alkyne có mạch nhánh:
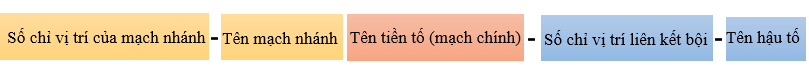
Ví dụ:
Tên gọi của một số alkene và alkyne:
| Tên | Công thức phân tử | Công thức cấu tạo | Tên | Công thức phân tử | Công thức cấu tạo |
| ethene | C2H4 | CH2=CH2 | ethyne | C2H3 | CH |
| propene | C3H6 | CH2=CHCH3 | propyne | C3H4 | CH |
| but-1-ene | C4H8 | CH2=CHCH2CH3 | but-1-yne | C4H6 | CH |
| 2-methylpropene | C4H8 | CH2=C(CH3)2 | but-2-yne | C4H6 | CH3C |
| pent-1-ene | C5H10 | CH2=CH[CH2]2CH3 | pent-1-yne | C5H8 | CH |
- Một số alkene và alkyne còn có tên gọi riêng.
Ví dụ: C2H4: ethylene; C2H2: acetylene; ...
II. Tính chất vật lí
- Alkene và alkyne có nhiều tính chất vật lí (nhiệt độ nóng chảy, nhiệt độ sôi, tỉ khối, tính tan, …) gần giống với alkane có cùng số nguyên tử carbon.
- Nhiệt độ nóng chảy, nhiệt độ sôi của alkene và alkyne thường tăng theo chiều tăng số nguyên tử carbon.
- Ở điều kiện thường, các alkene và alkyne có số nguyên tử carbon nhỏ hơn 5 tồn tại ở thể khí; các alkene, alkyne có mạch carbon dài hơn tồn tại ở thể lỏng hoặc rắn.
- Alkene và alkyne là các chất kém phân cực, vì thế chúng hầu như không tan trong nước nhưng tan tốt trong các dung môi hữu cơ….
III. Tính chất hóa học
Do trong phân tử có chứa liên kết ![]() \(\mathrm\pi\) nên alkene và alkyne dễ tham gia vào các phản ứng hoá học hơn so với alkane.
\(\mathrm\pi\) nên alkene và alkyne dễ tham gia vào các phản ứng hoá học hơn so với alkane.
1. Phản ứng cộng
a) Cộng hydrogen (hydrogen hóa)
- Alkene cộng hydrogen tạo thành alkane (xúc tác pllatinum, palladium hay nickel).
Ví dụ:
CH2 = CH2 + H2 ![]() \(\xrightarrow{\mathrm{Ni},\;\mathrm t^\circ\;\mathrm p}\) CH3 – CH3
\(\xrightarrow{\mathrm{Ni},\;\mathrm t^\circ\;\mathrm p}\) CH3 – CH3
- Phản ứng cộng hydrogen vào alkyne với xúc tác platinum, palladium hay nickel chủ yếu tạo thành alkane mà không dừng ở giai đoạn tạo alkene.
Ví dụ:
CH ≡ CH + 2H2 ![]() \(\xrightarrow{\mathrm{Ni},\;\mathrm t^\circ\;\mathrm p}\) CH3 – CH3
\(\xrightarrow{\mathrm{Ni},\;\mathrm t^\circ\;\mathrm p}\) CH3 – CH3
- Để hydrogen hóa alkyne thành alkene, cần sử dụng xúc tác Lindlar.
Ví dụ:
CH ≡ CH + H2 ![]() \(\xrightarrow{\mathrm{xt}\;\mathrm{Lindar},\;\mathrm t^\circ}\) CH2 = CH2
\(\xrightarrow{\mathrm{xt}\;\mathrm{Lindar},\;\mathrm t^\circ}\) CH2 = CH2
b) Cộng halogen (halogen hóa)
- Alkene bị halogen hóa tạo thành sản phẩm dihalogenoalkane.
Ví dụ:
CH2 = CH2 + Br2 → CH2Br – CH2Br
- Alkyne cộng halogen theo từng bước: trước tiên tạo dihalogenoalkane, sau đó tiếp tục cộng halogen để tạo tetrahalogenoalkane.
Ví dụ:
CH ≡ CH + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CHBr2 – CHBr2
Alkene và alkyne làm mất màu vàng nâu của dung dịch bromine. Vì thế, nước bromine được sử dụng để nhận biết hydrocarbon không no.
c) Cộng hydrogen halide (hydrohalogen hóa)
- Alkene tham gia phản ứng cộng hydrogen halide cho sản phẩm là monohalogenoalkane.
Ví dụ:
CH2 = CH2 + HCl → CH3 – CH2Cl
- Hydrogen halide cộng vào alkene không đối xứng (alkene có các nhóm thế khác nhau ở hai đầu liên kết đôi) sẽ tạo thành hỗn hợp sản phẩm.
Ví dụ:
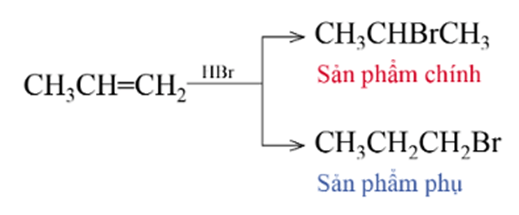
Quy tắc Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa ít hydrogen hơn (bậc cao hơn).
- Phản ứng cộng HX vào alkyne xảy ra lần lượt với từng liên kết ℼ và đều theo quy tắc Markovnikov.
d) Cộng nước (hydrate hóa)
- Phản ứng hydrate hóa alkene cho sản phẩm là alcohol (xúc tác acid mạnh (H+)).
Ví dụ:
CH2 = CH2 + H2O ![]() \(\xrightarrow{{\mathrm H}_2{\mathrm{SO}}_4}\) CH3 – CH2OH
\(\xrightarrow{{\mathrm H}_2{\mathrm{SO}}_4}\) CH3 – CH2OH
Phản ứng hydrate hóa alkene cũng tuân theo quy tắc Markovnikov.
- Hydrat hóa acetylene (xúc tác HgSO4) tạo ethanal. Hydrat hóa alkyne khác tạo sản phẩm chính là ketone.
Ví dụ:
CH≡CH + H2O ![]() \(\xrightarrow{{\mathrm{HgSO}}_4}\) [CH2=CHOH]
\(\xrightarrow{{\mathrm{HgSO}}_4}\) [CH2=CHOH] ![]() \(\rightarrow\) CH3-CHO
\(\rightarrow\) CH3-CHO
acetylene vinyl alcohol ethanal
CH3-CH≡CH + H2O ![]() \(\xrightarrow{{\mathrm{HgSO}}_4}\) CH3-COH=CH2
\(\xrightarrow{{\mathrm{HgSO}}_4}\) CH3-COH=CH2 ![]() \(\rightarrow\) CH3-CO-CH3
\(\rightarrow\) CH3-CO-CH3
2. Phản ứng trùng hợp alkene
Các phân tử alkene có thể cộng liên tiếp với nhau (dưới điều kiện nhiệt độ, áp suất xúc tác thích hợp) để tạo những mạch rất dài, có khối lượng phân tử lớn, gọi là polymer.
Ví dụ:
nCH2=CH2 ![]() \(\xrightarrow{\mathrm t^\circ,\;\mathrm{xt},\;\mathrm p}\) (-CH2-CH2-)n
\(\xrightarrow{\mathrm t^\circ,\;\mathrm{xt},\;\mathrm p}\) (-CH2-CH2-)n
3. Phản ứng của alk-1- yne với dung dịch silver nitrate trong ammonia
H-C≡C-H + 2[Ag(NH3)2]OH ![]() \(\rightarrow\) Ag-C≡C-Ag + 4NH3 + 2H2O
\(\rightarrow\) Ag-C≡C-Ag + 4NH3 + 2H2O
(kết tủa màu vàng nhạt)
Người ta dùng phản ứng này để nhận biết các alk-1-yne.
4. Phản ứng oxi hóa
a) Phản ứng với dung dịch potassium permanganate
Alkene và alkyne đều làm mất màu của dung dịch potassium permanganate (thuốc tím, KMnO4). Phản ứng này dùng để nhận biết các alkene và alkyne.
Ví dụ:
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH.
b) Phản ứng cháy
Sản phẩm của phản ứng đốt cháy hoàn toàn hydrocarbon không no đều là carbon dioxide và nước.
![]() \({\mathrm C}_{\mathrm n}{\mathrm H}_{2\mathrm n}\;+\;\frac{3\mathrm n}2{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}{\mathrm{nCO}}_2\;+\;{\mathrm{nH}}_2\mathrm O\)
\({\mathrm C}_{\mathrm n}{\mathrm H}_{2\mathrm n}\;+\;\frac{3\mathrm n}2{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}{\mathrm{nCO}}_2\;+\;{\mathrm{nH}}_2\mathrm O\)
![]() \({\mathrm C}_{\mathrm n}{\mathrm H}_{2\mathrm n-2}\;+\;\frac{3\mathrm n-1}2{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}{\mathrm{nCO}}_2\;+\;(\mathrm n-1){\mathrm H}_2\mathrm O\)
\({\mathrm C}_{\mathrm n}{\mathrm H}_{2\mathrm n-2}\;+\;\frac{3\mathrm n-1}2{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}{\mathrm{nCO}}_2\;+\;(\mathrm n-1){\mathrm H}_2\mathrm O\)
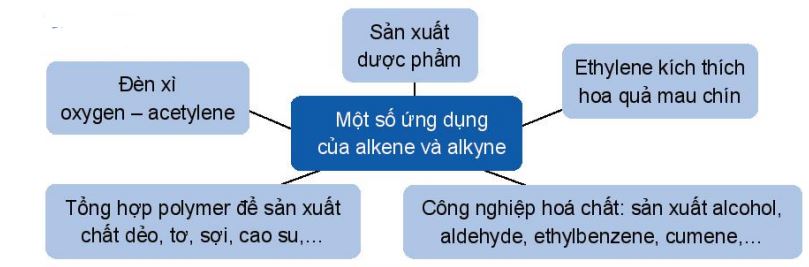
IV. Ứng dụng và điều chế
1. Ứng dụng
 2. Điều chế
2. Điều chế
- Trong công nghiệp, alkene thường được điều chế bằng phản ứng cracking alkane trong dầu mỏ.
- Alkene còn được điều chế bằng phản ứng tách nước (phản ứng dehydrate) từ các alcohol ở nhiệt độ cao với xúc tác sulfuric acid đặc, dung dịch phosphoric acid đặc hoặc aluminium oxide.
Ví dụ:
![]() \({\mathrm{CH}}_3–{\mathrm{CH}}_2\mathrm{OH}\;\xrightarrow[{170^{\mathrm o}\mathrm C}]{{\mathrm H}_2{\mathrm{SO}}_4\;\mathrm{đặc}}\;{\mathrm{CH}}_2=\;{\mathrm{CH}}_2\;+\;{\mathrm H}_2\mathrm O\;\)
\({\mathrm{CH}}_3–{\mathrm{CH}}_2\mathrm{OH}\;\xrightarrow[{170^{\mathrm o}\mathrm C}]{{\mathrm H}_2{\mathrm{SO}}_4\;\mathrm{đặc}}\;{\mathrm{CH}}_2=\;{\mathrm{CH}}_2\;+\;{\mathrm H}_2\mathrm O\;\)
- Một số phản ứng điều chế acetylene:
CaC2 + 2H2O → C2H2 + Ca(OH)2
2CH4 ![]() \(\xrightarrow{1500^\circ\mathrm C,\;\mathrm{LLN}}\) C2H2 + 3H2
\(\xrightarrow{1500^\circ\mathrm C,\;\mathrm{LLN}}\) C2H2 + 3H2
 2. Điều chế
2. Điều chế






