Hợp chất carbonyl
1. Khái niệm
Nhóm ![]() trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl. Aldehyde, ketone thuộc loại hợp chất carbonyl.
trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl. Aldehyde, ketone thuộc loại hợp chất carbonyl.
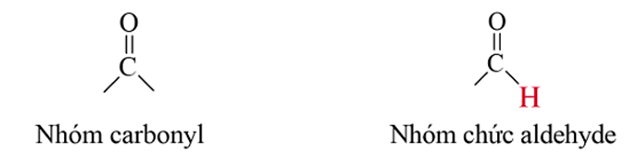
Aldehyde là hợp chất hữu cơ trong phân tử có nhóm –CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
Dãy đồng đẳng của aldehyde no, đơn chức, mạch hở, có công thức chung là CnH2n+1CH=O (n ![]() \(\geq\) 0).
\(\geq\) 0).
Ví dụ: methanal (HCH=O) và ethanal (CH3CH=O)
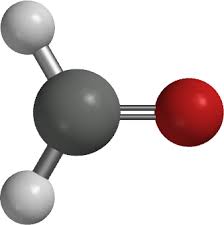
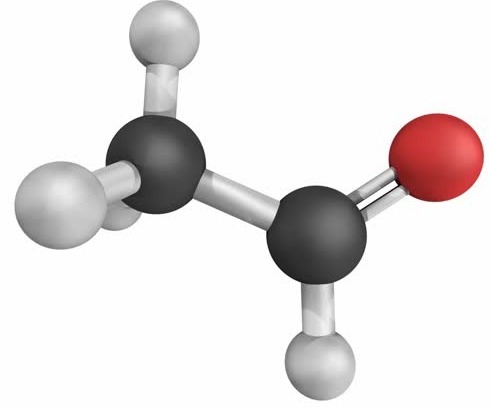
Mô hình phân tử methanal (formaldehyde) và ethanal (acetaldehyde)
Ketone là hợp chất hữu cơ có nhóm carbonyl liên kết trực tiếp với hai nguyên tử carbon.
![]() Công thức của ketone
Công thức của ketone
Ketone đơn giản nhất là acetone có công thức CH3COCH3.
2. Danh pháp
a) Tên thay thế
Công thức và tên theo danh pháp thay thế của một số aldehyde và ketone như sau:
| Aldehyde | Ketone | ||
| Công thức | Tên thay thế | Công thức | Tên thay thế |
| HCHO | methanal | CH3COCH3 | propanone |
| CH3CHO | ethanal | CH3CH2COCH3 | butanone |
| CH3CH2CHO | propanal | CH3CH2CH2COCH3 | pentan-2-one |
| CH3CH2CH2CHO | butanal | CH3CH2OCH2CH3 | pentan-3-one |
| CH3CH(CH3)CHO | 2-methylpropanal | C6H5COCH3 | 1-phenylethan-1-one |
| CH3[CH2]3CHO | pentanal | C6H5COCH3 | diphenylmethanone |
| C6H5CHO | phenylmethanal | ||
Tên thay thế của aldehyde và ketone được thiết lập như sau:
![]()
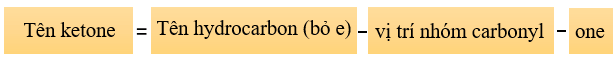
Chú ý: Đối với hợp chất carbonyl mạch nhánh hoặc có gốc hydrocarbon chưa no thì việc đánh số mạch chính bắt nguồn từ phía nào gần nhóm carbonyl hơn.
b) Tên thông thường
Tên thông thường của aldehyde:
- Các aldehyde mà acid tương ứng của chúng có tên thông thường thì có thể gọi tên thông thường bằng cách thay “… ic acid” bằng “ …ic aldehyde” hoặc “…aldehyde”.
- Tên thông thường của một số aldehyde
| Công thức | Tên thông thường |
| HCHO | formic aldehyde (formaldehyde) |
| CH3CHO | acetic aldehyde (acetaldehyde) |
| C6H5CHO | benzoic aldehyde (benzaldehyde) |
| CH2=CH-CHO | acrylic aldehyde (acrylaldehyde) |
| C6H5CH=CH-CHO | cinamie aldehyde (cinnamaldehyde) |
Tên thông thường của ketone: Một số ketone có tên thông thường.
Ví dụ:
CH3COCH3: Acetone;
C6H5COCH3: Acetophenone.
II. Tính chất vật lí
- Hai aldehyde đơn giản nhất (formic aldehyde và acetic aldehyde) là chất khí ở nhiệt độ thường. Các hợp chất carbonyl khác là chất lỏng hoặc chất rắn.
- Các hợp chất carbonyl có nhiệt đôi sôi, nhiệt độ nóng chảy thấp hơn nhiều so với các alcohol có cùng số nguyên tử carbon; nhưng có nhiệt độ sôi cao hơn nhiều so với hydrocarbon có phân tử khối tương đương.
- Các hợp chất carbonyl mạch ngắn tan tốt trong nước nhờ tạo liên kết hydrogen với nước, còn các hợp chất carbonyl mạch dài hơn không tan hoặc ít tan trong nước.
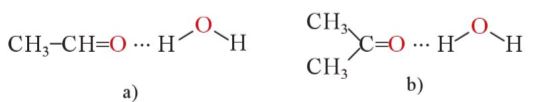
Liên kết hydrogen giữa phân tử acetaldehyde (a) và acetone (b) với nước
- Hợp chất carbonyl thơm hầu như không tan trong nước.
III. Tính chất hóa học
Trong hợp chất carbonyl, nhóm C=O có một số tính chất giống alkene.
1. Phản ứng khử hợp chất carbonyl
Dưới tác dụng của NaBH4 hoặc LiAlH4, aldehyde bị khử sinh ra alcohol bậc một; ketone bị khử sinh ra alcohol bậc hai.
Ví dụ:
CH3-CH=O ![]() \(\xrightarrow{{\mathrm{LiAlH}}_4}\) CH3CH2OH
\(\xrightarrow{{\mathrm{LiAlH}}_4}\) CH3CH2OH
CH3-CO-CH3 ![]() \(\xrightarrow{{\mathrm{NaBH}}_4}\) CH3-CHOH-CH3
\(\xrightarrow{{\mathrm{NaBH}}_4}\) CH3-CHOH-CH3
2. Phản ứng oxi hóa aldehyde
a) Phản ứng với nước bromine
Phương trình hóa học tổng quát khi cho aldehyde phản ứng với nước bromine:
R-CH=O + Br2 + H2O → R-COOH + 2HBr
Ví dụ:
CH3CHO + Br2 + H2O → CH3COOH + 2HBr
b) Phản ứng với thuốc thử Tollens
Thuốc thử Tollens là dung dịch AgNO3 trong NH3 dư:
AgNO3 + 3NH3 + H2O → [Ag(NH3)2]OH + NH4NO3
Phản ứng tổng quát giữa thuốc thử Tollens với aldehyde:
R-CH=O + 2[Ag(NH3)2]OH ![]() \(\overset{t^{\circ} }{\rightarrow}\) R-COONH4 + 2Ag + 3NH3 + H2O
\(\overset{t^{\circ} }{\rightarrow}\) R-COONH4 + 2Ag + 3NH3 + H2O
Ví dụ:
CH3-CH=O + 2[Ag(NH3)2]OH ![]() \(\overset{t^{\circ} }{\rightarrow}\) CH3-COONH4 + 2Ag + 3NH3 + H2O
\(\overset{t^{\circ} }{\rightarrow}\) CH3-COONH4 + 2Ag + 3NH3 + H2O
Phản ứng sinh ra lớp bạc bám trên thành ống nghiệm nên còn được gọi là phản ứng tráng bạc.
c) Phản ứng với Cu(OH)2
Phản ứng của aldehyde với Cu(OH)2 trong môi trường kiềm sinh ra kết tủa Cu2O màu đỏ gạch.
Ví dụ:
HCHO + 2Cu(OH)2 + NaOH ![]() \(\overset{t^{\circ} }{\rightarrow}\) HCOONa + Cu2O + 3H2O
\(\overset{t^{\circ} }{\rightarrow}\) HCOONa + Cu2O + 3H2O
màu xanh màu đỏ gạch
Chú ý: Ketone không có phản ứng với thuốc thử Tollens hoặc Cu(OH)2 trong môi trường kiềm nên có thể dùng thuốc thử Tollens hoặc Cu(OH)2 trong môi trường kiềm để phân biệt aldehyde và ketone.
3. Phản ứng với hydrogen cyanide
Hydrogen cyanide (HCN) phản ứng được với các aldehyde hoặc ketone tạo thành sản phẩm là các cyanohydrin.
Ví dụ:
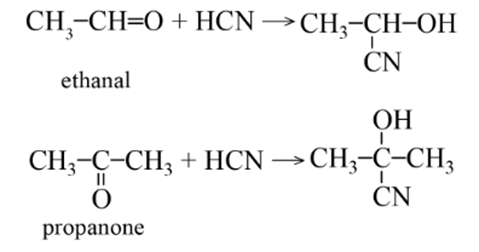
4. Phản ứng tạo iodoform
Hợp chất chứa nhóm methyl ketone (CH3CO-R) phản ứng với iodine trong môi trường kiềm tạo kết tủa iodoform màu vàng.

Phản ứng tạo iodoform
Ví dụ:
CH3CO-H + 3I2 + 4NaOH → H-COONa + 3NaI + CHI3 + 3H2O
CH3CO-CH3 + 3I2 + 4NaOH → CH3COONa + 3NaI + CHI3 + 3H2O
Phản ứng dùng để nhận biết hợp chất chứa nhóm CH3CO-.
IV. Ứng dụng và điều chế
1. Ứng dụng
a) Formaldehyde:
- Chủ yếu để sản xuất nhựa, phẩm nhuộm, chất nổ và dược phẩm.
- Dung dịch 37 - 40% formaldehyde trong nước được gọi là formalin, được dùng để ngâm xác động thực vật, tẩy uế, tiệt trùng.
b) Acetaldehyde (ethanal): để sản xuất dược phẩm hoặc các chất có ứng dụng trong thực tiễn.
c) Acetone: dùng làm dung môi trong trong sản xuất tơ nhân tạo, thuốc súng không khói,…Ngoài ra, acetone còn dùng nhiều trong tổng hợp bisphenol-A, chloroform, thuốc an thần,...
2. Điều chế
a) Điều chế acetaldehyde
Trong công nghiệp, acetaldehyde được điều chế bằng phương pháp oxi hóa ethylene:
2CH2=CH2 + O2 ![]() \(\overset{xt, t^{\circ} }{\rightarrow}\) 2CH3-CH=O
\(\overset{xt, t^{\circ} }{\rightarrow}\) 2CH3-CH=O
b) Điều chế acetone
Trong công nghiệp, acetone thu được trong quá trình oxi hóa cumene qua hai giai đoạn:
![]() \({\mathrm C}_6{\mathrm H}_5\mathrm{CH}{({\mathrm{CH}}_3)}_2\;\xrightarrow[{2)\;{\mathrm H}_2\mathrm O,\;{\mathrm H}_2{\mathrm{SO}}_4}]{1)\;{\mathrm O}_2\;(\mathrm{kk})}{\mathrm C}_6{\mathrm H}_5\mathrm{OH}+\;{\mathrm{CH}}_3{\mathrm{COCH}}_3\)
\({\mathrm C}_6{\mathrm H}_5\mathrm{CH}{({\mathrm{CH}}_3)}_2\;\xrightarrow[{2)\;{\mathrm H}_2\mathrm O,\;{\mathrm H}_2{\mathrm{SO}}_4}]{1)\;{\mathrm O}_2\;(\mathrm{kk})}{\mathrm C}_6{\mathrm H}_5\mathrm{OH}+\;{\mathrm{CH}}_3{\mathrm{COCH}}_3\)







