Một số hợp chất quan trọng của nitrogen
Bài học giới thiệu đến các em lý thuyết bài Một số hợp chất quan trọng của nitrogen. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 11 Cánh diều.
I. Ammonia
1. Cấu tạo phân tử và tính chất vật lí
Cấu tạo phân tử:
Được cấu tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen.
- Công thức Lewis:
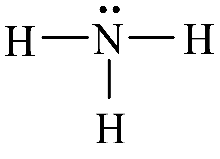
- Dạng hình học (hình chóp tam giác):
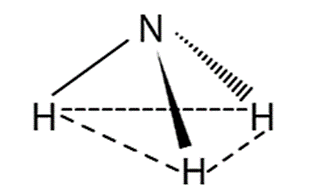
- Các liên kết N-H là liên kết cộng hóa trị nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
Tính chất vật lí:
- NH3 tồn tại trong cả môi trường đất, nước và không khí
- Ở điều kiện thường, ammonia là chất khí không màu, có mùi khai, xốc và độc.
2. Tính chất hóa học
a) Tính base
Khi tan trong nước, NH3 nhận H+ của nước, tạo thành ion NH4+, dung dịch có tính base, làm giấy quỳ tím hóa xanh:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
Khí NH3 hoặc dung dịch NH3 phản ứng với các acid. Ví dụ:
NH3(g) + HCl(aq) → NH4Cl(aq)
Dung dịch NH3 có thể tác dụng với muối của một số kim loại:
MgCl2(aq) + 2NH3(aq) + 2H2O(l) → Mg(OH)2(s) + 2NH4Cl(aq)
b) Tính khử
Nguyên tử N trong phân tử NH3 có số oxi hóa -3 (số oxi hóa thấp nhất của N) nên NH3 có tính khử:
![]() \(4\overset{-3}{\mathrm N}{\mathrm H}_4\;+\;3{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}\;2{\overset0{\mathrm N}}_2\;+\;6{\mathrm H}_2\mathrm O\)
\(4\overset{-3}{\mathrm N}{\mathrm H}_4\;+\;3{\mathrm O}_2\;\xrightarrow{\mathrm t^\circ}\;2{\overset0{\mathrm N}}_2\;+\;6{\mathrm H}_2\mathrm O\)
![]() \(4\overset{-3}{\mathrm N}{\mathrm H}_3\;+\;5{\mathrm O}_2\;\xrightarrow{800-900^\circ\mathrm C,\;\mathrm{Pt}}\;4\overset{-2}{\mathrm N}\mathrm O\;+\;6{\mathrm H}_2\mathrm O\)
\(4\overset{-3}{\mathrm N}{\mathrm H}_3\;+\;5{\mathrm O}_2\;\xrightarrow{800-900^\circ\mathrm C,\;\mathrm{Pt}}\;4\overset{-2}{\mathrm N}\mathrm O\;+\;6{\mathrm H}_2\mathrm O\)
3. Tổng hợp ammonia theo quá trình Haber
Trong công nghiệp, amomonia được tổng hợp theo quá trình Haber theo phương trình hóa học:
![]() \({\mathrm N}_2(\mathrm g)\;+\;3{\mathrm H}_2(\mathrm g)\;\overset{400-600^\circ\mathrm C,\;200\mathrm{bar},\;\mathrm{Fe}}\rightleftharpoons\;2{\mathrm{NH}}_3(\mathrm g)\)
\({\mathrm N}_2(\mathrm g)\;+\;3{\mathrm H}_2(\mathrm g)\;\overset{400-600^\circ\mathrm C,\;200\mathrm{bar},\;\mathrm{Fe}}\rightleftharpoons\;2{\mathrm{NH}}_3(\mathrm g)\)
Để cân bằng chuyển dịch theo chiều thuận, tạo thành ammonia, cần chọn các điều kiện thích hợp về áp suất, nhiệt độ, dựa theo nguyên lí chuyển dịch Le Chatelier.
II. Muối ammonium
Muối amminium là các hợp chất có chứa ion ammonium (NH4+).
1. Tính tan và sự điện li
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl → NH4+ + Cl-
2. Tác dụng với kiềm – Nhận biết ion ammonium
Đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai và xốc:
Ví dụ: (NH4)2SO4 + 2NaOH ![]() \(\xrightarrow{\mathrm t^\circ}\) 2NH3 + Na2SO4 + 2H2O
\(\xrightarrow{\mathrm t^\circ}\) 2NH3 + Na2SO4 + 2H2O
Phương trình ion rút gọn: NH4+ + OH- ![]() \(\xrightarrow{\mathrm t^\circ}\) NH3 + H2O (OH- nhận proton).
\(\xrightarrow{\mathrm t^\circ}\) NH3 + H2O (OH- nhận proton).
3. Tính chất kém bền nhiệt
Các muối ammonium kém bền với nhiệt nên dễ bị phân hủy ở nhiệt độ cao.
Ví dụ:
NH4Cl ![]() \(\xrightarrow{\mathrm t^\circ}\) NH3 + HCl
\(\xrightarrow{\mathrm t^\circ}\) NH3 + HCl
NH4HCO3 ![]() \(\xrightarrow{\mathrm t^\circ}\) NH3 + CO2 + H2O
\(\xrightarrow{\mathrm t^\circ}\) NH3 + CO2 + H2O
NH4NO3 ![]() \(\xrightarrow{\mathrm t^\circ}\) N2O + H2O
\(\xrightarrow{\mathrm t^\circ}\) N2O + H2O
III. Ứng dụng của ammonia và một số muối ammonium
Ứng dụng của ammonia:
- Sản xuất phân đạm ammonium, urea ((NH2)2CO), ...
- Sản xuất nitric acid, sản xuất một số chất gây nổ.
- Ammonia lỏng được sử dụng làm dung môi để hòa tan một số chất.
Ứng dụng của một số muối ammonium:
- Chất đánh sạch bề mặt kim loại.
- Thuốc long đờm.
- Phân bón hóa học.
- Chất phụ gia thực phẩm.
- Thuốc bổ sung chất điện giải.
IV. Nguồn gốc một số oxide của nitrogen trong không khí – mưa acid
1. Nguồn gốc một số oxide của nitrogen
- Bầu khí quyển có các oxide của nitrogen như NO, NO2 (kí hiệu chung NOx).
- Tạo ra từ quá trình tự nhiên. Ví dụ: NO trong khí quyển được tạo ra khi có sấm sét.
- Hoạt động của con người như: hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy điện và trong đời sống.
2. Mưa acid
Nguyên nhân: Các khí NO, NO2 cùng với SO2 trong khí quyển là nguyên nhân chính dẫn tới sự có mặt của nitric acid và sulfuric acid hòa tan trong nước mưa.
Quá trình hình thành:
SO2(g) + ![]() \(\frac{1}{2}\)O2(g)
\(\frac{1}{2}\)O2(g) ![]() \(\xrightarrow{\mathrm{NO}\;\mathrm{hoặc}\;{\mathrm{NO}}_2}\) SO3(g)
\(\xrightarrow{\mathrm{NO}\;\mathrm{hoặc}\;{\mathrm{NO}}_2}\) SO3(g)
SO3(g) + H2O(l) → H2So4(aq)
Tác hại: Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng đến cây trồng, thủy sản,... Các acid này cũng ăn mòn các kết cấu kim loại, biến đổi các thành phần vật liệu của các công trình.
V. Nitric acid
Mô hình cấu tạo của phân tử nitric acid:
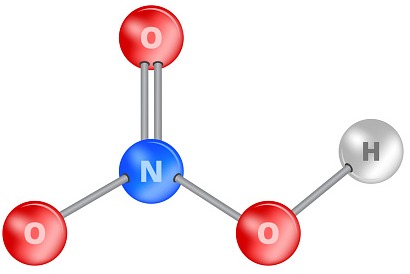
Công thức Lewis:
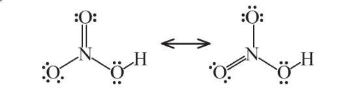
Nitric acid là chất lỏng, không màu, có tính acid mạnh và tính oxi hóa mạnh.
Mỗi năm có hàng chục triệu tấn nitric acid được sản xuất trên toàn cầu. Trong đó, khoảng 80% được dùng cho sản xuất phân đạm ammonium nitrate và khoảng 10% được dùng để oxi hóa các hợp chất hữu cơ trong quá trình sản xuất adipic acid, nitrobenzene và thuốc nổ.
VI. Hiện tượng phú dưỡng

Khái niệm: Hiện tượng phú dưỡng là sự tích tụ lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người.
Nguyên nhân: Do sự dư thừa chất dinh dưỡng
Hệ quả: Cản trở sự hấp thụ ánh sáng mặt trời vào nước, giảm sự quang hợp của thực vật thủy sinh. Rong, tảo phát triển mạnh gây thiếu oxygen, gây mất cân bằng sinh thái. Ngoài ra, xác rong tảo phân hủy gây ô nhiễm môi trường nước, không khí và tạp chất bùn lắng xuống lòng ao.
Biện pháp:
- Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông.
- Xử lí nước thải trước khi cho chảy vào kênh, rạch, ao, hồ.
- Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm.







