pH của dung dịch. Chuẩn độ acid - base
Bài học giới thiệu đến các em lý thuyết bài pH của dung dịch. Chuẩn độ acid - base. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 11 Cánh diều.
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
- Nước là chất điện li yếu. Phương trình điện li của H2O như sau:
H2O ![]() \(\leftrightharpoons\) H+ + OH-
\(\leftrightharpoons\) H+ + OH-
Ở 25oC, [H+] = [OH-] = 10-7 là rất nhỏ, vậy nên nước được coi là chất không điện li.
- Khi thêm acid vào nước, [H+] tăng nên trong dung dịch acid có [H+] > [OH-]. Khi hòa tan base vào nước, [OH-] tăng lên trong dung dịch base có [OH-] > [H+].
- Tính acid, base của một dung dịch đã cho được đánh giá bằng pH là một đại lượng liên hệ trực tiếp với nồng độ H+.
pH = -lg[H+] ![]() \(\Leftrightarrow\) [H+] = 10-pH
\(\Leftrightarrow\) [H+] = 10-pH
Lấy [H+] = 10-7 làm mốc trung gian, ta có:
| [H+] | pH | |
| Môi trường trung tính | 10-7 | 7 |
| Môi trường acid | > 10-7 | < 7 |
| Môi trường base | < 10-7 | > 7 |
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch
- Giá trị pH càng nhỏ hơn 7, dung dịch có tính acid càng mạnh.
- Giá trị pH càng lớn hơn 7, dung dịch có tính base (tính kiềm) càng lớn.
2. Ý nghĩa của pH trong thực tiễn
- Nhiều quá trình hóa học trong tự nhiên, sản xuất và cơ thể sống xảy ra trong dung dịch nước với sự có mặt của acid và base.
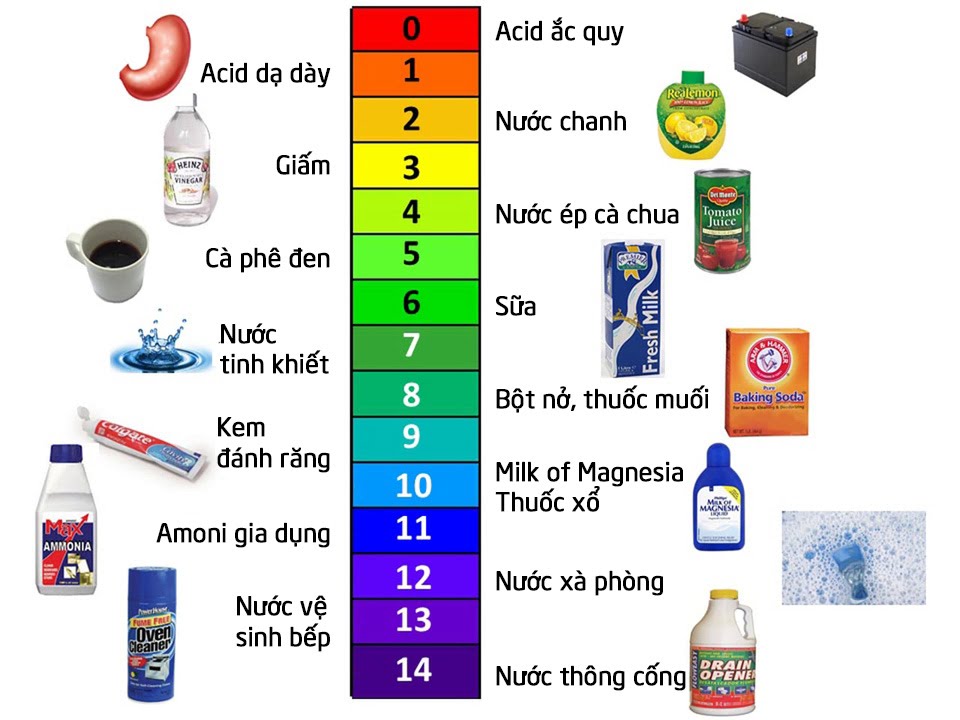
- Thông thường, các quá trình này diễn ra trong điều kiện ổn định về thành phần các chất và ion trong đó có nồng độ H+.
3. Xác định pH bằng chất chỉ thị
- Một số chất chỉ thị như quỳ tím, phenolphathalein, methyl da cam,… có màu sắc khác nhau trong môi trường acid và môi trường base.
| Chất chỉ thị | Màu chỉ thị | |
| Môi trường acid | Môi trường base | |
| Quỳ tìm | Đỏ | Xanh |
| Phenolphtalein | Không màu | Hồng |
| Methyl da cam | Đỏ | Vàng cam |
- Để biết giá trị pH gần đúng của dung dịch: sử dụng giấy chỉ thị pH
 II. Chuẩn độ dung dịch acid và base
II. Chuẩn độ dung dịch acid và base
Chuẩn độ là phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch khác đã biết nồng độ.
Nguyên tắc: xác định nồng độ của một dung dịch base mạnh bằng một dung dịch acid mạnh (hoặc ngược lại) đã biết trước nồng độ dựa theo phản ứng trung hòa:
H+ + OH- ![]() \(\rightarrow\) H2O
\(\rightarrow\) H2O
Để nhận ra điểm tương đương, cần dùng thêm chất chỉ thị acid - base, thông qua sự thay đổi màu của chất chỉ thị.
 II. Chuẩn độ dung dịch acid và base
II. Chuẩn độ dung dịch acid và base






