Carboxylic acid
1. Khái niệm
Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
Dãy đồng đẳng của carboxylic no, đơn chức, mạch hở có công thức chung là CnH2n+1COOH (n ![]() \(\geq\) 0).
\(\geq\) 0).
Ví dụ: acetic acid (CH3COOH)
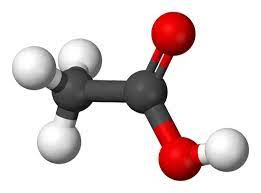
Mô hình phân tử của acetic acid
2. Danh pháp
Danh pháp thay thế của monocarboxylic acid có mạch carbon no mạch hở:

Đối với carboxylic acid đơn chức, mạch nhánh hoặc carboxylic acid đơn chức có mạch carbon không no:
- Chọn mạch chính là mạch dài nhất, có chứa nhóm –COOH, liên kết bội (nếu có).
- Đánh số mạch chính bắt đầu từ nhóm –COOH.
- Gọi tên.
Ví dụ:
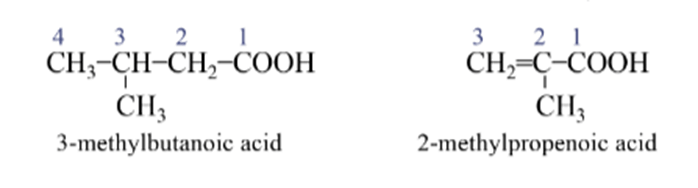
Tên thông thường: một số carboxylic acid cũng có tên thông thường.
Tên thay thế, tên thông thường của một số carboxylic acid:
| Công thức | Tên thay thế | Tên thông thường |
| HCOOH | methanoic acid | formic acid |
| CH3COOH | ethanoic acid | acetic acid |
| CH3CH2COOH | propanoic acid | propionic acid |
| CH3CH2CH2COOH | butanoic acid | butyric acid |
| CH3CH2CH2CH2COOH | pentanoic acid | valeric acid |
| CH2=CH-COOH | propenoic acid | acrylic acid |
| CH2=C(CH3)-COOH | methylpropenoic acid | methacrylic acid |
| HCOO-COOH | ethanedioic acid | oxalic acid |
| C6H5-COOH | benzoic acid | benzoic acid |
II. Tính chất vật lí
- Ở điều kiện thường, các carboxylic acid đều ở thể lỏng hoặc rắn.
- Nhiệt độ sôi của các carboxylic acid no, đơn chức, mạch hở tăng dần theo chiều tăng của nguyên tử khối. Nhiệt độ sôi của các carboxylic acid cao hơn nhiệt độ sôi của các alcohol có cùng số nguyên tử carbon (do liên hết hydrogen giữa các phân tử acid bền hơn).
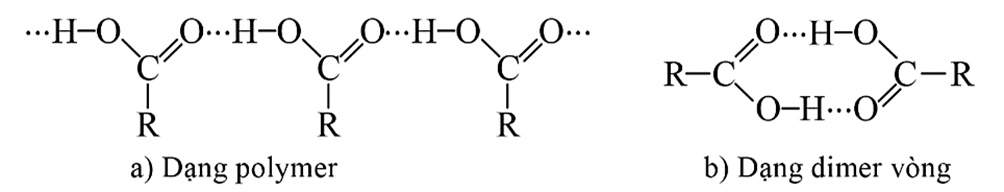
Liên kết hydrogen giữa các phân tử carboxylic acid
- Các carboxylic acid tan tốt trong nước do có khả năng tạo liên kết hydrogen với nước. Carboxylic acid có phân tử khối thấp tan vô hạn trong nước như formic acid, acetic acid, propionic acid, ...
- Độ tan giảm dần theo chiều tăng của số nguyên tử carbon trong phân tử.
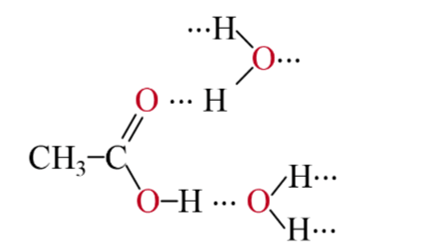
Liên kết hydrogen giữa phân tử acetic acid và nước
- Mỗi carboxylic acid có một vị chua riêng biệt. Acetic acid tạo vị chua của giấm; oxalic acid tạo vị chua của me; citric acid tạo vị chua của chanh; tartaric acid tạo vị chua của nho,…
III. Tính chất hóa học
Carboxylic acid thể hiện tính acid và tham gia phản ứng ester hoá.
1. Tính acid
Carboxylic acid điện li không hoàn toàn theo cân bằng:
R-COOH ![]() \(\rightleftharpoons\) R-COO- + H+
\(\rightleftharpoons\) R-COO- + H+
![]() \({\mathrm K}_{\mathrm a}=\frac{\lbrack\mathrm{RCOO}^-\rbrack\lbrack\mathrm H^+\rbrack}{\lbrack\mathrm{RCOOH}\rbrack}\)
\({\mathrm K}_{\mathrm a}=\frac{\lbrack\mathrm{RCOO}^-\rbrack\lbrack\mathrm H^+\rbrack}{\lbrack\mathrm{RCOOH}\rbrack}\)
Giá trị Ka của một số carboxylic acid:
| Acid | HCOOH | CH3COOH | C2H5COOH | C6H5COOH |
| Ka (ở 25oC) | 17,72.10-5 | 1,75.10-5 | 1,35.10-5 | 6,25.10-5 |
Dung dịch carboxylic acid làm quỳ tím chuyển đỏ.
a) Phản ứng với kim loại
Dung dịch carboxylic acid phản ứng được với các kim loại trước hydrogen trong dãy hoạt động hoá học của kim loại giải phóng H2.
Ví dụ:
2CH3COOH + Zn → (CH3COO)2Zn+ H2
b) Phản ứng với các base và oxide base
Ví dụ:
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
CH3COOH + NaOH → CH3COONa + H2O
c) Phản ứng với muối
Ví dụ:
2CH3COOH + Na2CO3 → CH3COONa + H2O + CO2
2. Phản ứng este hóa
Phản ứng giữa alcohol và carboxylic acid tạo thành ester được gọi là phản ứng ester hóa. Ester sinh ra thường ít tan trong nước, nổi lên trên và thường có mùi thơm đặc trưng.
Phương trình hóa học tổng quát:
RCOOH + H-O-R’ ![]() \(\overset{H_{2}SO_{4}đặc, t^{\circ} }{\rightleftharpoons}\) RCOOR’ + H2O
\(\overset{H_{2}SO_{4}đặc, t^{\circ} }{\rightleftharpoons}\) RCOOR’ + H2O
Ví dụ:
CH3COOH + HOC2H5 ![]() \(\overset{H_{2}SO_{4}đặc, t^{\circ} }{\rightleftharpoons}\) CH3COOC2H5 + H2O
\(\overset{H_{2}SO_{4}đặc, t^{\circ} }{\rightleftharpoons}\) CH3COOC2H5 + H2O
Chú ý: Phản ứng ester hoá diễn ra thuận nghịch và cần chất xúc tác để xảy ra nhanh hơn.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Acetic acid dùng để sản xuất vinyl acetate và cellulose acetate; tổng hợp aluminium monoacetate làm chất cầm màu trong công nghiệp dệt may; tổng hợp ethyl acetate, muối ammonium acetate, phenylacetic acid,… Dung dịch acetic acid 2% - 5% được dùng làm giấm ăn, chất tẩy cặn trong siêu đun nước và nhiều ứng dụng khác.
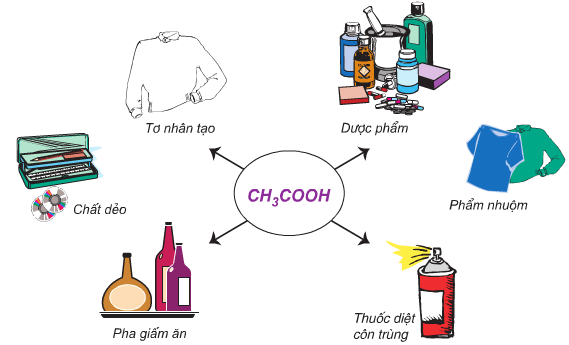
Một số ứng dụng của acetic acid
- Acrylic acid và methacrylic acid được dùng để sản xuất thủy tinh hữu cơ. Benzoic acid với liều lượng nhỏ được dùng làm chất bảo quản thực phẩm. Salicylic acid được dùng để sản xuất thuốc cảm aspirin, thuốc giảm đau. Một số acid béo được dùng để sản xuất xà phòng. Một số dicarboxylic acid tổng hợp polyester, polyamide…để sản xuất tơ sợi.
2. Điều chế
- Trong công nghiệp, các carboxylic acid được sản xuất bằng phương pháp oxi hóa các alkane khai thác từ dầu mỏ:
2R-CH2-CH2 -R’ + 5O2 ![]() \(\overset{xt,t^{\circ} }{\rightarrow}\) 2R-COOH + 2R’-COOH + 2H2O
\(\overset{xt,t^{\circ} }{\rightarrow}\) 2R-COOH + 2R’-COOH + 2H2O
Ví dụ: Điều chế acetic acid
2CH3CH2CH2CH3 + 5O2 ![]() \(\overset{xt,t^{\circ} }{\rightarrow}\) 4CH3COOH + 2H2O
\(\overset{xt,t^{\circ} }{\rightarrow}\) 4CH3COOH + 2H2O
- Điều chế acetic acid bằng phương pháp lên men giấm:
C2H5OH + O2 ![]() \(\xrightarrow{men\;giấm}\) C2H5OH + O2
\(\xrightarrow{men\;giấm}\) C2H5OH + O2







