Xác định phương trình điện li được viết đúng
Phương trình điện li nào dưới đây được viết đúng?
Các phương trình điện li khi viết đúng là:
CuCl2 → Cu2+ + 2Cl–.
H2S ⇌ 2H+ + S2–.
NaOH → Na+ + OH–.
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 11 tháng 11, cùng nhau luyện tập và xem kết quả nha!
Xác định phương trình điện li được viết đúng
Phương trình điện li nào dưới đây được viết đúng?
Các phương trình điện li khi viết đúng là:
CuCl2 → Cu2+ + 2Cl–.
H2S ⇌ 2H+ + S2–.
NaOH → Na+ + OH–.
Xác định chất là chất điện li yếu
Chất nào sau đây là chất điện li yếu?
CH3COOH là acid yếu nên phân li một phần trong nước ⇒ là chất điện li yếu.
Xác định chất không dẫn được điện
Chất nào không dẫn điện?
NaOH rắn không có sự phân li ra các ion trái dấu (hạt mang điện) nên không dẫn được điện.
Xác định pH của dung dịch
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch. Một dung dịch X có [OH–] = 10–3 M thì dung dịch X có pH bằng
pH = –log[H+] = –log(10–11) = 11
Ở điều kiện thường, sulfur là chất rắn
Ở điều kiện thường, sulfur là chất rắn, màu
Ở điều kiện thường, sulfur là chất rắn, màu vàng.
Dạng hình học của phân tử ammonia
Phân tử ammonia có dạng hình học nào sau đây?
Phân tử ammonia có dạng hình học hình chóp tam giác.
Cân bằng chuyển dịch khi tăng nhiệt độ
Cho các cân bằng sau:
CaCO3(s) CaO(s) + CO2(g),
= 176 kJ (1)
2SO2(g) + O2(g) 2SO3(g),
= –198 kJ (2)
Khi tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào?
Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g)
= 176 kJ > 0 ⇒ Chiều thuận thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
2. Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g)
= –198 kJ < 0 ⇒ Chiều thuận toả nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
Tính chất không phải tính chất của dung dịch sulfuric acid đặc
Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
Tính khử không phải tính chất của acid sulfuric đặc.
Thuốc thử nhận biết 4 dung dịch
Có 4 dung dịch đựng trong 4 lọ mất nhãn là: NaOH, NH4Cl, Na2SO4, (NH4)2SO4. Nếu chỉ được phép sử dụng một thuốc thử để nhận biết 4 dung dịch trên, có thể dùng dung dịch
Nhỏ dung dịch Ba(OH)2 vào các mẫu thử của các dung dịch mất nhãn, ta có bảng kết quả:
| NaOH | NH4Cl, | Na2SO4, | (NH4)2SO4 | |
| Hiện tượng | Không hiện tượng | Khí mùi khai | Kết tủa trắng | Khí mùi khai và kết tủa trắng |
Xác định phản ứng S là chất khử
S là chất khử trong phản ứng nào sau đây?
Ta có, trong phản ứng:
S là chất nhường electron → là chất khử.
Xác định số thí nghiệm xảy ra phản ứng oxi hóa - khử
Tiến hành các thí nghiệm cho dung dịch H2SO4 đặc lần lượt tác dụng với: Al, NaHCO3, BaCl2, CaCO3. Số thí nghiệm xảy ra phản ứng oxi hoá – khử là
Trong số các chất, chỉ có Al khi tác dụng với H2SO4 đặc xảy ra phản ứng oxi hóa - khử.
Cấu hình electron nguyên tử của nitrogen
Cấu hình electron nguyên tử của nitrogen là
Cấu hình electron nguyên tử của nitrogen là 1s22s22p3.
Màu của quỳ tím khi cho vào dung dịch
Khi cho quỳ tím vào dung dịch có [H+] = 1,5.10–12 M thì quỳ tím
Ta có [H+] = 1,5.10–12 < 10–7 → Dung dịch có mỗi trường base → làm quỳ tím hóa xanh.
Cách pha loãng dung dịch acid H2SO4 đặc
Muốn pha loãng dung dịch acid H2SO4 đặc, cần phải làm thế nào?
Sulfuric acid tan tốt trong nước. Quá trình hòa tan tỏa lượng nhiệt lớn. Vì vậy để đảm bảo an toàn khi pha loãng dung dịch sulfuric acid đặc, phải cho từ từ acid đặc vào nước, không được cho nước vào acid.
Thể tích khí N2 trong khí quyển
Trong khí quyển, nguyên tố nitrogen tồn tại chủ yếu dưới dạng đơn chất N2. Khí nitrogen chiếm khoảng bao nhiêu phần trăm thể tích không khí?
Trong khí quyển ,nguyên tố nitrogen tồn tại chủ yếu dưới dạng đơn chất N2. Khí nitrogen chiếm khoảng 78% thể tích không khí.
Hóa chất không thể dùng để làm khô khí NH3
Hóa chất không thể dùng để làm khô khí NH3 là
H2SO4 đặc tác dụng đuuợc với khí NH3 nên không thể dùng làm khôi khí NH3.
Tính khối lượng kết tủa thu được
Khối lượng kết tủa (g) thu được khi cho 100 ml dung dịch Ba(OH)2 0,1 M vào 200 ml dung dịch MgSO4 0,1 M là
nBa(OH)2 = 0,01 (mol); nMgSO4 = 0,02 mol
Phương trình phản ứng:
Ba(OH)2 + MgSO4 → BaSO4↓ + Mg(OH)2↓
nBa(OH)2 < nMgSO4 → tính theo số mol của Ba(OH)2.
⇒ m↓ = mBaSO4 + mMg(OH)2 = 0,01.233 + 0,01.58 = 2,91 (g)
Công thức Lewis của phân tử NH3
Công thức Lewis của phân tử NH3 là
Công thức Lewis của phân tử NH3 là:
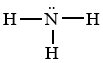
Yếu tố không làm ảnh hưởng đến chuyển dịch cân bằng hóa học
Yếu tố nào dưới đây không làm ảnh hưởng đến chuyển dịch cân bằng hóa học?
Yếu tố không làm ảnh hưởng đến chuyển dịch cân bằng hóa học là chất xúc tác.
Xác định chất X
Khí X làm đục nước vôi trong và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy. Chất X là:
Khí SO2 làm đục nước vôi trong và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy.
Tìm nhận xét đúng, nhận xét sai
Trong những nhận xét dưới đây, nhận xét nào là đúng, nhận xét nào là sai?
a) Nitrogen không duy trì sự cháy và sự hô hấp.Đúng||Sai
b) Ở nhiệt độ thường nitrogen khá trơ về mặt hóa học.Đúng||Sai
c) Số oxi hóa của nitrogen trong các hợp chất NH3, N2O4, HNO3 lần lượt là +3, +4, –5.Sai||Đúng
d) Khi tác dụng với kim loại hoạt động, nitrogen thể hiện tính khử.Sai||Đúng
Trong những nhận xét dưới đây, nhận xét nào là đúng, nhận xét nào là sai?
a) Nitrogen không duy trì sự cháy và sự hô hấp.Đúng||Sai
b) Ở nhiệt độ thường nitrogen khá trơ về mặt hóa học.Đúng||Sai
c) Số oxi hóa của nitrogen trong các hợp chất NH3, N2O4, HNO3 lần lượt là +3, +4, –5.Sai||Đúng
d) Khi tác dụng với kim loại hoạt động, nitrogen thể hiện tính khử.Sai||Đúng
a) Đúng.
b) Đúng.
c) Sai. Số oxi hóa của nitrogen trong các hợp chất NH3, N2O4, HNO3 lần lượt là –3, +4, +5.
d) Sai. Khi tác dụng với kim loại hoạt động, nitrogen thể hiện tính oxi hóa.
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai.
a) Giá trị [H+] tăng thì độ acid tăng.Đúng||Sai
b) Dung dịch có pH < 7 làm quỳ tím hoá đỏ.Đúng||Sai
c) Dung dịch có pH = 7 thì có môi trường trung tính.Đúng||Sai
d) Giá trị pH tăng thì độ acid tăng.Sai||Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai.
a) Giá trị [H+] tăng thì độ acid tăng.Đúng||Sai
b) Dung dịch có pH < 7 làm quỳ tím hoá đỏ.Đúng||Sai
c) Dung dịch có pH = 7 thì có môi trường trung tính.Đúng||Sai
d) Giá trị pH tăng thì độ acid tăng.Sai||Đúng
a) Đúng.
b) Đúng. Dung dịch có pH < 7 → có môi trường acid → làm quỳ tím hóa đỏ.
c) Đúng.
Dung dịch có pH < 7 thì có môi trường acid.
Dung dịch có pH = 7 thì có môi trường trung tính.
Dung dịch có pH > 7 thì có môi trường base.
d) Sai. Giá trị pH tăng thì nồng độ H+ giảm, nồng độ OH– tăng → độ acid giảm.
Chọn ý kiến đúng hoặc sai
Chọn ý kiến đúng hoặc sai về sulfur dioxide (SO2) trong các ý kiến sau.
(a) Không có độc tính đối với con người.Sai||Đúng
(b) Phản ứng được với đá vôi.Đúng||Sai
(c) Khí này được tạo thành từ hoạt động của núi lửa trong tự nhiên, từ quá trình đốt cháy nhiên liệu hoá thạch của con người,…Đúng||Sai
(d) Là oxide lưỡng tính.Sai||Đúng
Chọn ý kiến đúng hoặc sai về sulfur dioxide (SO2) trong các ý kiến sau.
(a) Không có độc tính đối với con người.Sai||Đúng
(b) Phản ứng được với đá vôi.Đúng||Sai
(c) Khí này được tạo thành từ hoạt động của núi lửa trong tự nhiên, từ quá trình đốt cháy nhiên liệu hoá thạch của con người,…Đúng||Sai
(d) Là oxide lưỡng tính.Sai||Đúng
(a) sai, SO2 là khí độc đối với con người, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp.
(b) đúng.
(c) đúng.
Chú ý: Bột đá vôi có thể phản ứng được SO2 theo phản ứng:
CaCO3(s) + SO2(g) ⟶ CaSO3(s) + CO2(g)
Phản ứng này được ứng dụng để xử lí khí thải SO2 từ nhà máy điện đốt than và dầu mỏ.
(d) sai vì SO2 là oxide acid.
Xác định nhận định đúng, sai
Giá trị pH của một dung dịch tăng từ 2 lên 4. Ở mỗi nhận định sau, hãy chọn đúng hoặc sai.
a) Nồng độ ion H+ của dung dịch khi pH = 2 là 10–2 M.Đúng||Sai
b) Nồng độ ion H+ của dung dịch giảm 20 lần.Sai||Đúng
c) Nồng độ ion OH– của dung dịch khi pH = 4 là 10–10 M.Đúng||Sai
d) Dung dịch ban đầu là một acid có nồng độ 0,01 M.Đúng||Sai
Giá trị pH của một dung dịch tăng từ 2 lên 4. Ở mỗi nhận định sau, hãy chọn đúng hoặc sai.
a) Nồng độ ion H+ của dung dịch khi pH = 2 là 10–2 M.Đúng||Sai
b) Nồng độ ion H+ của dung dịch giảm 20 lần.Sai||Đúng
c) Nồng độ ion OH– của dung dịch khi pH = 4 là 10–10 M.Đúng||Sai
d) Dung dịch ban đầu là một acid có nồng độ 0,01 M.Đúng||Sai
a) đúng. Ta có pH = –log[H+] ⇒ 2 = –log[H+] ⇔ [H+] = 10–2 M.
b) sai. Ta có:
Khi pH = 2: pH = –log[H+] = 2 ⇒ [H+] = 10–2 M.
Khi pH = 4: pH = –log[H+] = 4 ⇒ [H+] = 10–4 M.
⇒ Nồng độ H+ giảm đi lần.
c) đúng. pH = 4 ⇒ [H+] = 10–4 ⇒ [OH–] = = 10–10 M.
d) đúng. Dung dịch ban đầu có pH = 2 ⇒ [H+] = 10–2 M hay 0,01 M.
Hoàn thành phản ứng
Hoàn thành phản ứng sau:
a) (NH4)2SO4 + KOH
b) CuO + HNO3
c) NH4NO3 ![]()
d) Fe + 4HNO3 loãng → NO
Hoàn thành phản ứng sau:
a) (NH4)2SO4 + KOH
b) CuO + HNO3
c) NH4NO3 ![]()
d) Fe + 4HNO3 loãng → NO
a) (NH4)2SO4 + 2KOH → K2SO4 + 2NH3 + 2H2O
b) CuO + 2HNO3 → Cu(NO3)2 + H2O
c) NH4NO3 N2O + 2H2O
d) Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Mô tả sự khác nhau khi hoà tan các chất vào nước
Sodium hydroxide (NaOH) là một chất điện li mạnh, trong khi methanol (C2H5OH) là chất không điện li. Hãy mô tả sự khác nhau khi hoà tan các chất trên vào nước. Viết các phương trình minh hoạ.
Sodium hydroxide (NaOH) là một chất điện li mạnh, trong khi methanol (C2H5OH) là chất không điện li. Hãy mô tả sự khác nhau khi hoà tan các chất trên vào nước. Viết các phương trình minh hoạ.
NaOH(aq) Na+(aq) + OH–(aq);
C2H5OH(l) → C2H5OH(aq).
Khi hòa tan vào nước, NaOH phân li hoàn toàn thành các ion, còn C2H5OH không phân li mà tồn tại chủ yếu ở dạng phân tử.
Tính hằng số cân bằng KC của phản ứng tại 405oC
Cho phản ứng sau: H2(g) + I2(g) ⇌ 2HI(g). (1)
Nồng độ các chất lúc cân bằng ở nhiệt độ 405oC là [H2] = [I2] = 0,107 M; [HI] = 0,786 M. Tính hằng số cân bằng KC của phản ứng (1) tại 405oC.
Cho phản ứng sau: H2(g) + I2(g) ⇌ 2HI(g). (1)
Nồng độ các chất lúc cân bằng ở nhiệt độ 405oC là [H2] = [I2] = 0,107 M; [HI] = 0,786 M. Tính hằng số cân bằng KC của phản ứng (1) tại 405oC.
H2(g) + I2(g) ⇌ 2HI(g)
cb: 0,107 0,107 0,786 (M)
Tính giá trị của m
Hòa tan m gam Fe trong dung dịch H2SO4 dư, sau khi phản ứng kết thúc thu được 4,958 lít khí H2 (ở đkc). Tính giá trị của m.
Hòa tan m gam Fe trong dung dịch H2SO4 dư, sau khi phản ứng kết thúc thu được 4,958 lít khí H2 (ở đkc). Tính giá trị của m.
nH2 = 0,2 (mol)
Fe + H2SO4 → FeSO4 + H2
mol: 0,2 ← 0,2
⇒ m = 0,2.56 = 11,2 (g)
Tính nồng độ H+ và pH của dung dịch X
Một dung dịch X thu được bằng cách thêm 50,0 mL dung dịch HBr 0,050 M vào 150,0 mL dung dịch HI 0,100 M. Tính nồng độ H+ và pH của dung dịch X. Biết HBr và HI đều được coi là acid mạnh.
Một dung dịch X thu được bằng cách thêm 50,0 mL dung dịch HBr 0,050 M vào 150,0 mL dung dịch HI 0,100 M. Tính nồng độ H+ và pH của dung dịch X. Biết HBr và HI đều được coi là acid mạnh.
Số mol H+ trong 50 mL HBr là: 0,05.0,050 = 2,5.10−3 (mol).
Số mol H+ trong 150 mL HI là: 0,15.0,100 = 1,5.10−2 (mol).
Nồng độ H+ của dung dịch X là:
pH = –lg(0,0875) = 1,06.pH = –lg(0,0875) = 1,06.
Viết phương trình hóa học xảy ra và tính V
Cho 9,6 gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thu được dung dịch X và V lít khí SO2 (đkc, sản phẩm khử duy nhất của S+6).
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Tính V.
c) Khi làm thí nghiệm trên để hạn chế khí SO2 thoát ra gây ô nhiễm môi trường, người ta thường nút ống nghiệm bằng bông tẩm dung dịch chất nào? Vì sao?
Cho 9,6 gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thu được dung dịch X và V lít khí SO2 (đkc, sản phẩm khử duy nhất của S+6).
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Tính V.
c) Khi làm thí nghiệm trên để hạn chế khí SO2 thoát ra gây ô nhiễm môi trường, người ta thường nút ống nghiệm bằng bông tẩm dung dịch chất nào? Vì sao?
a) Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
b) nCu = 0,15 mol
Từ phương trình hoá học trên ta có: nSO2 = 0,15 mol
→ VSO2 = 0,15. 24,79 = 3,7185 (L)
c) Để hạn chế khí SO2 thoát ra người ta thường nút ống nghiệm bằng bông tẩm dung dịch NaOH. Vì khi SO2 bay lên sẽ xảy ra phản ứng:
SO2 + 2NaOH → Na2SO3 + H2O
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

