Bộ đề thi Hóa 8 giữa học kì 2 năm học 2022 - 2023 Có đáp án
Bộ đề kiểm tra học giữa học kì 2 Hóa 8 Có đáp án
- A. Tài liệu ôn tập giữa học kì 2 Hóa 8
- B. Một số đề thi giữa học kì 2 Hóa 8 có đáp án
- C. Đề thi Hóa 8 giữa học kì 2
- Đề thi hóa 8 giữa học kì 2 - Đề số 1
- Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 1
- Đề thi hóa 8 giữa học kì 2 - Đề số 2
- Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 2
- Đề thi hóa 8 giữa học kì 2 - Đề số 3
- Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 3
- Đề thi hóa 8 giữa học kì 2 - Đề số 4
- Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 4
- Đề thi hóa 8 giữa học kì 2 - Đề số 5
Bộ đề thi hóa 8 giữa học kì 2 năm học 2022 - 2023 Có đáp án được VnDoc biên soạn, tổng hợp. Đây là bộ tài liệu hay cho các em học sinh tham khảo, ôn luyện trước kỳ thi, đồng thời cũng là tài liệu hữu ích cho thầy cô tham khảo ra đề. Sau đây mời các bạn tham khảo chi tiết.
A. Tài liệu ôn tập giữa học kì 2 Hóa 8
- Bộ đề thi giữa học kì 2 lớp 8 môn Hóa học - Số 1
- Các dạng bài tập Hóa 8 đầy đủ từ cơ bản đến nâng cao
- Tóm tắt kiến thức Hóa học 8
- Đề cương ôn tập học kì 2 môn Hóa học lớp 8 năm 2023
- 20 Bộ đề thi hóa 8 học kì 2 năm 2023 Có đáp án
- Tổng hợp câu hỏi trắc nghiệm ôn tập kì 2 Hóa 8 năm 2022
B. Một số đề thi giữa học kì 2 Hóa 8 có đáp án
- Đề thi giữa học kì 2 lớp 8 môn Hóa năm 2023 Đề 1
- Đề thi Hóa giữa kì 2 lớp 8 năm 2023 Đề 2
- Đề thi giữa học kì 2 môn Hóa học lớp 8 năm học 2023 Đề 1
- Đề thi giữa học kì 2 môn Hóa học lớp 8 năm học 2023 Đề 2
- Đề thi giữa học kì 2 môn Hóa học lớp 8 năm học 2023 Đề 3
- Đề thi giữa học kì 2 môn Hóa học lớp 8 năm học 2023 Đề 4
C. Đề thi Hóa 8 giữa học kì 2
ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 MÔN HÓA HỌC 8
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề thi hóa 8 giữa học kì 2 - Đề số 1
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phương trình hóa học nào dưới đây không xảy ra phản ứng.
A. 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
B. 4Ag + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag2O
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag2O
C. CO + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2
\(\overset{t^{\circ } }{\rightarrow}\) CO2
D. 2Cu + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CuO
\(\overset{t^{\circ } }{\rightarrow}\) 2CuO
Câu 2. Tên gọi của oxit N2O5 là
A. Đinitơ pentaoxit
B. Đinitơ oxit
C. Nitơ (II) oxit
D. Nitơ (II) pentaoxit
Câu 3. Chất tác dụng với nước tạo ra dung dịch axit là:
A. CaO
B. BaO
C. Na2O
D. SO3
Câu 4. Dãy chất sau đây chỉ gồm các oxit:
A. MgO; Ba(OH)2; CaSO4; HCl
B. MgO; CaO; CuO; FeO
C. SO2; CO2; NaOH; CaSO4
D. CaO; Ba(OH)2; MgSO4; BaO
Câu 5. Dãy hóa chất nào dưới đây dùng để điều chế oxi trong phòng thí nghiệm
A. Không khí, KMnO4
B. KMnO4, KClO3
C. NaNO3, KNO3
D. H2O, không khí
Câu 6. Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS + H2
C. MgCO3 → MgO + CO2
D. KMnO4 → MnO2 + O2 + K2O
Câu 7. Người ta thu khí oxi bằng cách đẩy nước là nhờ dựa vào tính chất.
A. Khí oxi tan trong nước
B. Khí oxi ít tan trong nước
C. Khí oxi khó hóa lỏng
D. Khí oxi nhẹ hơn nước
Câu 8. Thành phần các chất trong không khí:
A. 9% Nitơ, 90% Oxi, 1% các chất khác
B. 91% Nitơ, 8% Oxi, 1% các chất khác
C. 50% Nitơ, 50% Oxi
D. 21% Oxi, 78% Nitơ, 1% các chất khác
Câu 9. Phương pháp nào để dập tắt lửa do xăng dầu?
A. Quạt
B. Phủ chăn bông hoặc vải dày
C. Dùng nước
D. Dùng cồn
Câu 10. Tính khối lượng KMnO4 biết nhiệt phân thấy 2,7552 l khí bay lên
A. 38,678 g
B. 37,689 g
C. 38,868 g
D. 38,886 g
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phản ứng các phương trình hóa học sau
a) P2O5 + H2O → ....
b) Mg + HCl → .....+ .....
c) KMnO4 → ......+ ......+ O2
d) K + H2O → ....
e) C2H4 + O2 → ......+ H2O
Câu 2. (2 điểm)
a. Trong dãy các oxit sau: H2O; Al2O3; CO2; FeO; SO3; P2O5; BaO. Phân loại oxit và gọi tên tương ứng với mỗi oxit đó?
b. Trong một oxit của kim loại R (hóa trị II), nguyên tố R chiếm 71,429% về khối lượng. Tìm công thức phân tử và gọi tên của oxit trên.
Câu 3. (3 điểm) Đốt cháy hoàn toàn 23,3 gam hỗn hơp 2 kim loại Mg và Zn trong bình kín đựng khí oxi, sau phản ứng xảy ra hoàn toàn thu được 36,1 gam hỗn hợp 2 oxit.
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí oxi (đktc) đã dùng để đốt cháy lượng kim loại trên
c) Tính khối lượng mỗi kim loại trong hỗn hợp trên.
---------------HẾT---------------
Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 1
Phần 1. Trắc nghiệm (3 điểm)
Mỗi câu đúng 0,3 điểm
| 1B | 2A | 3D | 4B | 5B |
| 6C | 7B | 8D | 9B | 10C |
Phần 2. Tự luận (7 điểm)
Câu 1.
a) P2O5 + H2O → H3PO4
b) Mg + 2HCl → MgCl2 + H2
c) 2KMnO4 → K2MnO4 + MnO2 + O2
d) 2K + H2O → 2KOH
e) C2H4 + 3O2 → 2CO2 + 2H2O
Câu 2. a
| Oxit axit | Oxit bazo | Tên gọi tương ứng |
| Na2O | Natri oxit | |
| Al2O3 | Nhôm oxit | |
| CO2 | Cacbonđioxit | |
| N2O5 | Đinito pentaoxit | |
| FeO | Sắt (II) oxit | |
| SO3 | Lưu trioxit | |
| P2O5 | Điphotpho pentaoxit |
b.
Gọi CT của oxit kim loại R là RO (x,y ∈N∈N*)
![]() \(\%m_{R} = 71,43\% = > \frac{M_{R}}{M_{R} + 16} = 0,7143\)
\(\%m_{R} = 71,43\% = > \frac{M_{R}}{M_{R} + 16} = 0,7143\)
MR = 0,7143MR + 11,4288
⇔ MR = 40
⇒ R là Ca
CTPT: CaO, tên gọi: Canxi oxit
Câu 3.
Phương trình hóa học.
2Mg + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MgO
\(\overset{t^{\circ } }{\rightarrow}\) 2MgO
2Zn + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2ZnO
\(\overset{t^{\circ } }{\rightarrow}\) 2ZnO
b) Áp dụng bảo toàn khối lượng
mhh + moxi = moxit => moxi = moxit - mhh = 36,1 - 23,3 = 12,8 gam
Số mol của oxi bằng
 \(\begin{array}{l} n{O_2} = \frac{{12,8}}{{32}} = 0,4(mol)\\ = > {V_{{O_2}}} = {n_{{O_2}}}.22,4 = 0,4.22,4 = 8,96(l) \end{array}\)
\(\begin{array}{l} n{O_2} = \frac{{12,8}}{{32}} = 0,4(mol)\\ = > {V_{{O_2}}} = {n_{{O_2}}}.22,4 = 0,4.22,4 = 8,96(l) \end{array}\)
Gọi x, y lần lượt là số mol của Mg, Zn
2Mg + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)2MgO
\(\overset{t^{\circ } }{\rightarrow}\)2MgO
x → x/2
2Zn + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)2ZnO
\(\overset{t^{\circ } }{\rightarrow}\)2ZnO
y ![]() \(\rightarrow\) y/2
\(\rightarrow\) y/2
Khối lượng hỗn hợp ban đầu: mhh = mMg +mZn = 24x + 65y = 23,3 (1)
Số mol của oxi ở cả 2 phương trình là: x/2 + y/2 = 0,4 (1)
Sử dụng phương pháp thế giải được x = nMg = 0,7mol, y =nZn = 0,1 mol
=> mMg = 0,7.24 = 16,8 gam
mZn = 0,1.65 = 6,5 gam
Đề thi hóa 8 giữa học kì 2 - Đề số 2
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Chất tác dụng với nước tạo ra dung dịch axit là:
A. K2O
B. CuO
C. P2O5
D. CaO
Câu 2. Tên gọi của oxit Cr2O3 là
A. Crom oxit
B. Crom (II) oxit
C. Đicrom trioxit
D. Crom (III) oxit
Câu 3. Đâu là tính chất của oxi
A. Không màu, không mùi, ít tan trong nước
B. Không màu, không mùi, tan nhiều trong nước
C. Không màu, có mùi hắc, ít tan trong nước
D. Màu trắng, không mùi, tan nhiều trong nước
Câu 4. Để bảo quản thực phẩm, người ta không sử dụng biện pháp nào sau đây?
A. Bơm khí CO2 vào túi đựng khí thực phẩm
B. Hút chân không
C. Dùng màng bọc thực phẩm
D. Bơm khí O2 vào túi đựng thực phẩm
Câu 5. Phản ứng nào dưới đây là phản ứng hóa hợp
A. NaOH + HCl → NaCl + H2O
B. 2Mg + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MgO
\(\overset{t^{\circ } }{\rightarrow}\) 2MgO
C. 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
D. Na + H2O → 2NaOH + H2
Câu 6. Đốt cháy sắt thu được 0,2 mol Fe3O4. Thể tích khí oxi (đktc) đã dùng là
A. 8,96 lít
B. 4,48 lít
C. 2,24 lít
D. 3,36 lít
Câu 7. Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng hợp chất nào sau đây?
A. KMnO4
B. H2O
C. CaCO3
D. Na2CO3
Câu 8. Điều kiện phát sinh phản ứng cháy là:
A. Chất phải nóng đến nhiệt độ cháy
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy
D. Cả A & B
Câu 9. Khí Oxi không phản ứng được với chất nào dưới đây.
A. CO
B. C2H4
C. Fe
D. Cl2
Câu 10. Sự cháy và sự oxi hóa chậm đều là quá trình
A. Oxi hóa có tỏa nhiệt phát sáng
B. Oxi hóa có tỏa nhiệt, không phát sáng
C. Oxi hóa có phát sáng
D. Oxi hóa có tỏa nhiệt
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Viết phương trình hóa học của phản ứng xảy giữa oxi và các chất sau:
a) Na, Ca, Al, Fe.
b) S, SO2, C2H4
Câu 2. (2,5 điểm) Đốt cháy 12,4 gam photpho trong bình chứa 20,8 gam khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, màu trắng).
a) Photpho hay oxi, chất nào còn dư và số mol chất dư là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
Câu 3. (1,5 điểm) Phân loại các oxit sau thuộc oxit bazo, oxit axit
MgO, FeO, SO2, Fe2O3, SO3, P2O5, Na2O, CuO, ZnO, CO2, N2O, N2O5, SiO2, CaO
Câu 4. (1 điểm) Đốt nóng 2,4 gam kim loại M trong khí oxi dư, thu được 4,0 gam chất rắn. Xác định kim loại M.
-------------Hết------------
Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 2
Phần 1. Trắc nghiệm (3 điểm)
| 1C | 2C | 3A | 4B | 5B |
| 6A | 7A | 8D | 9D | 10D |
Phần 2. Tự luận (7 điểm)
Câu 1.
a) 4Na + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Na2O
\(\overset{t^{\circ } }{\rightarrow}\) 2Na2O
2Ca + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)CaO
\(\overset{t^{\circ } }{\rightarrow}\)CaO
2Al + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
3Fe + 2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)Fe3O4
\(\overset{t^{\circ } }{\rightarrow}\)Fe3O4
b) S + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
2SO2 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2SO3
\(\overset{t^{\circ } }{\rightarrow}\) 2SO3
C2H4 + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 2H2O
Câu 2.
Số mol phopho: nP = mP/MP = 2,4/31 = 0,4 (mol)
Số mol oxi: nO2 = mO2 = 20,8/32 = 0,65 mol
Phương trình hóa học của phản ứng: 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
Trước phản ứng: 0,4 0,65 (mol)
Phản ứng: 0,4 0,5 0,2 (mol)
Sau phản ứng: 0 0,15 0,2 (mol)
a) So sánh tỉ lệ: nP/4 = 0,4/4 = 0,1 < nO2/4 = 0,65/5 = 0,13 => P phản ứng hết, oxi còn dư.
Tính toán theo số mol P.
Số mol oxi dư bằng: 0,65 - 0,5 = 0,15 mol
b) Chất được tạo thành là điphopho pentaoxit P2O5
Khối lượng P2O5 tạo thành: mP2O5 = n.M = 0,2.142 = 28,4 gam
Câu 3.
Oxit axit: SO2, SO3, P2O5, CO2, N2O, N2O5, SiO2
Oxit bazo: MgO, FeO, Fe2O3, Na2O, CuO, ZnO, CaO
Câu 4. Gọi hóa trị của M là n (đk: n nguyên dương)
Sơ đồ phản ứng: M + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) M2On
\(\overset{t^{\circ } }{\rightarrow}\) M2On
Áp dụng định luật bảo toàn khối lượng:
mM + mO2 = mM2On => 2,4 + mO2 = 4,0 => mO2 = 3,6 gam => nO2 = 0,05 mol
Phương trình hóa học phản ứng:
4M + nO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2M2On
\(\overset{t^{\circ } }{\rightarrow}\) 2M2On
0,05.4/n 0,05
Số mol kim loại M bằng: nM = 0,05.4/n = 0,2/n mol
Khối lượng kim loại M: mM = nM.M => M = 12n
Lập bảng:
| n | 1 | 2 | 3 |
| M | 12 (loại) | 24 (Mg) | 36 (loại) |
Vậy kim loại M là Mg
Đề thi hóa 8 giữa học kì 2 - Đề số 3
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phần trăm khối lượng của Cu trong CuO là
| A. 60% | B. 70% | C. 80% | D. 50% |
Câu 2. Khi cho dây sắt cháy trong bình kín đựng khí oxi. Hiện tượng xảy ra đối với phản ứng trên là:
A. Sắt cháy sáng, có ngọn lửa màu đỏ, không khói, tạo các hạt nhỏ nóng đỏ màu nâu.
B. Sắt cháy sáng, không có ngọn lửa, tạo khói trắng, sinh ra các hạt nhỏ nóng chảy màu nâu.
C. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo các hạt nhỏ nóng chảy màu nâu.
D. Sắt cháy từ từ, sáng chói, có ngọn lửa, không có khói, tạo các hạt nhỏ nóng chảy màu nâu
Câu 3. Để điều chế 1 lượng khí oxi thì sử dụng hóa chất nào dưới đây để khối lượng dùng nhỏ nhất?
| A. H2O | B. KMnO4 | C. KNO3 | D. KClO3 |
Câu 4. Phản ứng nào sau đây là phản ứng phân hủy
A. 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
C. Fe(OH)3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
C. CO + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2
\(\overset{t^{\circ } }{\rightarrow}\) CO2
D. 2Cu + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CuO
\(\overset{t^{\circ } }{\rightarrow}\) 2CuO
Câu 5. Trong công nghiệp sản xuất khí oxi bằng cách
A. Chưng cất không khí
B. Lọc không khí
C. Hóa lỏng không khí, sau đó chiết lấy oxi
D. Hóa lỏng không khí, sau đó cho không khí lỏng bay hơi
Câu 6. Công thức hóa học của sắt oxit, biết Fe (III) là:
| A. Fe2O3 | B. Fe3O4 | C. FeO | D. Fe3O2 |
Câu 7. Cho biết ứng dụng nào dưới đây không phải của oxi?
A. Sử dụng trong đèn xì oxi - axetilen.
B. Cung cấp oxi cho bệnh nhân khó thở
C. Phá đá bằng hỗn hợp nổ có chứa oxi lỏng
D. Điều chế khí hidro trong phòng thí nghiệm
Câu 8. Sự cháy và sự oxi hóa chậm đều là quá trình
A. Oxi hóa có tỏa nhiệt phát sáng
B. Oxi hóa có tỏa nhiệt, không phát sáng
C. Oxi hóa có phát sáng
D. Oxi hóa có tỏa nhiệt
Câu 9. Chất tác dụng với nước tạo ra dung dịch bazơ là:
| A. K2O | B. CuO | C. CO | D. SO2 |
Câu 10. Chỉ ra các oxit bazơ: P2O5, CaO, CuO, BaO, Na2O, P2O3
A. P2O5, CaO, CuO
B. CaO, CuO, BaO, Na2O
C. BaO, Na2O, P2O3
D. P2O5, CaO, P2O3
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phương trình hóa học sau
1) MgCl2 + KOH → .... + KCl
2) FeO + HCl → ..... + H2O
3) Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
4) P + O2 → .....
5) NO2 + O2 + H2O → HNO3
Câu 2. (2 điểm) Phân loại và gọi tên các oxit sau: P2O5, Fe2O3, CuO, NO2, CaO, SO3, SiO2
Câu 3: (3 điểm) Cho 13 gam Kẽm tác dụng vứi 24,5 gam H2SO4, sau phản ứng thu được muối ZnSO4, khí hidro (đktc) và chất còn dư
a) Viết phương trình phản ứng hóa học
b) Tính thể tích (đktc) khí hidro sinh ra.
c) Tính khối lượng các chất còn lại sau phản ứng
---------------Hết---------------
..........................
Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 3
Phần 1. Trắc nghiệm
| 1C | 2C | 3A | 4A | 5D |
| 6A | 7D | 8D | 9A | 10B |
Phần 2. Tự luận
Câu 1.
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) FeO + 2HCl → FeCl2 + H2O
3) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
4) 4P + 5O2 → 2P2O5
5) 4NO2 + O2 + 2H2O → 4HNO3
Câu 2.
Oxit axit: P2O5: Đi photpho pentaoxit, NO2: nito đioxit, SO3: lưu huỳnh trioxit, SiO2, Silic đioxit
Oxit bazo: Fe2O3: Sắt (III) oxit, CuO: Đồng oxit, CaO: Canxi oxit
Câu 3.
Hướng dẫn giải
a) Phương trình phản ứng hóa học:
Zn + H2SO4 (loãng) → ZnSO4 + H2
b) nZn = ![]() \(\frac{13}{65}\) = 0,2 mol
\(\frac{13}{65}\) = 0,2 mol
nH2SO4 = ![]() \(\frac{24,5}{98}\) = 0,25 mol
\(\frac{24,5}{98}\) = 0,25 mol
Phương trình phản ứng hóa học: Zn + H2SO4 (loãng) → ZnSO4 + H2
Theo phương trình: 1 mol 1 mol 1 mol
Theo đầu bài: 0,2 mol 0,25 mol
Xét tỉ lệ: ![]() \(\frac{0,2}{1}<\frac{0,25}{1}\)
\(\frac{0,2}{1}<\frac{0,25}{1}\)
Zn phản ứng hết, H2SO4 dư, phản ứng tính theo số mol Zn
Số mol của khí H2 phản ứng là: nZn = nH2 = 0,2 mol
Thể tích khí H2 bằng: VH2 = 0,2 . 22,4 = 4,48 lít
c) Chất còn lượng sau phản ứng là ZnSO4 và H2SO4 dư
Số mol của ZnSO4 bằng: nZnSO4 = nZn = 0,2 mol
Khối lượng của ZnSO4 bằng: mZnSO4 = 0,2 . 161 = 32,2 gam
Số mol của H2SO4 dư = Số mol của H2SO4 ban đầu - Số mol của H2SO4 phản ứng = 0,25 - 0,2 = 0,05 mol
Khối lương H2SO4 dư = 0,05 . 98 = 4,9 gam
Đề thi hóa 8 giữa học kì 2 - Đề số 4
Câu 1. Hoàn thành các PTHH (ghi rõ điều kiện phản ứng nếu có)
SO3 + H2O →
Al + O2 →
SO3 + H2O →
Na2O + H2O →
CaCO3 →
FeS2 + O2 → Fe2O3 + SO2
Câu 2.
a. Phân đạm urê, có công thức hoá học là (NH2)2CO. Phân đạm có vai trò rất quan trọng đối với cây trồng và thực vật nói chung, đặc biệt là cây lấy lá như rau.
- Khối lượng mol phân tử ure
- Hãy xác định thành phần phần trăm (theo khối lượng) của các nguyên tố N
b. Hãy tìm công thức hóa học của chất X có khối lượng mol MX= 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
Câu 3. Điền các thông tin còn thiếu vào bảng sau:
Tên gọi oxit | Công thức hóa học | Phân loại |
Natri oxit | ||
SO2 | ||
Cl2O5 | ||
Sắt (III) oxit | ||
Đi nito penta oxit | N2O5 | |
CuO |
Câu 4. Đốt cháy 12,4 gam photpho trong bình chứa 20,8 gam khí oix tạo thành điphotpho pentaoxit P2O5 (là chất rắn, màu trắng)
a) Viết phương trình hóa học
b) Photpho hay oxi, chất nào còn dư và số mol chất dư là bao nhiêu?
c) Chất nào được tạo thành? Khối lượng là bao nhiêu?
Đáp án Đề thi hóa 8 giữa học kì 2 - Đề số 4
Câu 1.
SO3 + H2O → H2SO4
4Al + 3O2![]() 2Al2O3
2Al2O3
SO2 + O2 ![]() SO3
SO3
Na2O + H2O → NaOH
CaCO3 CaO + CO2
4FeS2 + 11O2![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Câu 2.
a) Xác định khối lượng mol của hợp chất.
M(NH2)2CO = 14.2+ 2.2 + 12 + 16 = 60 g/mol
Tính thành phần % của mỗi nguyên tố.
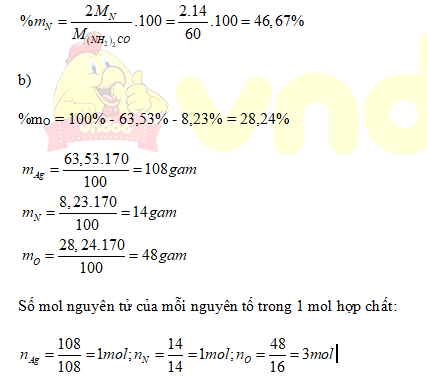
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
Phân tử hợp chất khí trên có: 1mol nguyên tử Ag; 1 mol nguyên tử N và 3 mol nguyên tử O.
Công thức hóa học của hợp chất trên là AgNO3
Câu 3.
Tên gọi oxit | Công thức hóa học | Phân loại |
Natri oxit | Na2O | Oxit bazo |
Lưu huỳnh đioxit | SO2 | Oxit axit |
dDdiclo pentaoxit | Cl2O5 | Oxit axit |
Sắt (III) oxit | Fe2O3 | Oxit bazo |
Đi nito penta oxit | N2O5 | Oxit axit |
Đồng (II) oxit | CuO | Oxit bazo |
Câu 4.
nP = 12,4/31 = 0,4 mol
nO2 = 20,8/32 = 0,65 mol
Phương trình hóa học:
4P + 5O2 -> 2P2O5
Theo đề bài: 0,4 0,65 (mol)
Phản ứng: 0,4 0,5 0,2 (mol)
Sau phản ứng: 0 0,15 0,2 (mol)
So sánh tỉ lệ nP/4 = 0,4/4 = 0,12 < nO2/5 = 0,65/5 = 0,13 => P phản ứng hết, oxi còn dư. Tính toán theo số mol P.
Số mol dư bằng: 0,65 - 0,5 = 0,15 (mol)
c) Chất được tạp thành P2O5
mP2O5 = 0,2.142 = 28,4 (gam)
Đề thi hóa 8 giữa học kì 2 - Đề số 5
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phát biểu nào sau đây về oxi là không đúng
A. Oxi là phi kim hoạt động hoá học rất mạnh, nhất là ở nhịêt độ cao
B. Oxi không có mùi, không vị
C. Oxi tạo oxit axit với hầu hết kim loại
D. Oxi cần thiết cho sự sống
Câu 2. Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Câu 3. Chất tác dụng với nước tạo ra dung dịch làm quỳ tím hóa xanh là:
A. BaO
B. Fe2O3
C. CO2
D. SO3
Câu 4. Dãy chất sau đây chỉ gồm các oxit bazơ
A. MgO; CaO; CuO; FeO
B. MgO; CO2; CaO; CO
C. SO2; CO2; MgO; CuO
D. CO2; SO2; MgO; BaO
Câu 5. Dãy hóa chất nào dưới đây dùng để điều chế oxi trong phòng thí nghiệm
A. Không khí, KMnO4
B. KMnO4, KClO3
C. NaNO3, KNO3
D. H2O, không khí
Câu 6. Phản ứng nào là phản ứng hóa hợp
A. Zn + H2SO4 loãng → ZnSO4+ H2↑
B. CaO + H2O → Ca(OH)2
C. CaCO3 ![]() \(\overset{t^{o} }{\rightarrow}\)CaO + CO2↑
\(\overset{t^{o} }{\rightarrow}\)CaO + CO2↑
D. Fe + 2HCl → FeCl2 + H2↑
Câu 7. Người ta thu khí oxi bằng cách đẩy không khí là nhờ dựa vào tính chất
A. khí oxi nhẹ hơn không khí
B. khí oxi ít tan trong nước
C. khí oxi dễ trộn lẫn với không khí
D. khí oxi nặng hơn không khí
Câu 8. Quá trình nào dưới đây không làm giảm lượng oxi trong không khí
A. Sự hô hấp của động vật
B. Sự cháy của than, củi, bếp ga
C. Sự gỉ của các vật dụng bằng sắt
D. Sự quang hợp của cây xanh
Câu 9. Hòa tan 11,28 gam K2O vào nước dư, thu được m gam KOH. Tính m
A. 6,72 gam.
B. 13,44 gam.
C. 8,4 gam.
D. 8,96 gam
Câu 10. Khi oxi hoá 9,6 gam kim loại R bằng oxi thu được 16 gam oxit RO. R là kim loại nào sau đây?
A. Fe
B. Ca
C. Mg
D. Pb
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phản ứng các phương trình hóa học sau
a) N2O5 + H2O → ....
b) Zn + HCl → .....+ .....
c) KMnO4 → ......+ ......+ O2
d) Ca(OH)2 + → CaCO3 + H2O
e) C2H6 + O2 → ......+ H2O
Câu 2. (2 điểm)
a. Trong dãy các oxit sau: SiO2; ZnO; CO2; Fe3O4; SO3; N2O5; NO2. Phân loại oxit và gọi tên tương ứng với mỗi oxit đó?
b. Trong một oxit của kim loại R (hóa trị III), nguyên tố oxi chiếm 30% về khối lượng. Tìm công thức phân tử và gọi tên của oxit trên.
Câu 3. (3 điểm) Đốt cháy một hỗn hợp gồm bột nhôm và magie trong đó bột magie là 2,4 gam cần 7,84 lít khí oxi (đktc).
a) Viết phương trình hóa học xảy ra.
c) Tính % về khối lượng của mỗi kim loại trong hỗn hợp.
>> Đáp án đề thi giữa học kì 2 Hóa học 8 đề số 5 tại: Đề thi giữa học kì 2 lớp 8 môn Hóa năm 2023
---------------HẾT---------------
Mời các bạn ấn vào link TẢI VỀ bên dưới để tải toàn bộ đề thi giữa học kì 2 môn hóa học lớp 8
.................................
Trên đây VnDoc đã gửi tới các bạn Bộ đề thi hóa 8 giữa học kì 2 năm học 2022 - 2023 Có đáp án. Để chuẩn bị cho kì thi giữa học kì 2 sắp tới, ngoài việc ôn tập theo đề cương, các em học sinh cần thực hành luyện đề để làm quen với nhiều dạng bài khác nhau, đồng thời nắm được cấu trúc đề thi. Chuyên mục Đề thi giữa kì 2 lớp 8 với đầy đủ các môn, là tài liệu hay cho các em tham khảo, ôn tập.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.


