Bộ đề thi giữa học kì 2 lớp 8 môn Hóa học - Số 1
Bộ đề thi giữa học kì 2 môn Hóa học lớp 8
Mời các bạn tham khảo Bộ đề thi giữa học kì 2 lớp 8 môn Hóa học - Số 1 do VnDoc tổng hợp sau đây. Tài liệu giúp các bạn học sinh củng cố lại phần kiến thức đã học và kỹ năng giải đề thi giữa học kì 2 Hóa 8. Cũng như biết cách phân bổ thời gian làm bài sao cho hợp lý. Mời các bạn cùng tham khảo.
A. Tài liệu ôn tập giữa học kì 2 Hóa 8
- Bộ đề thi giữa học kì 2 lớp 8 môn Hóa học - Số 1
- Các dạng bài tập Hóa 8 đầy đủ từ cơ bản đến nâng cao
- Tóm tắt kiến thức Hóa học 8
- Đề cương ôn tập học kì 2 môn Hóa học lớp 8
- 20 Bộ đề thi hóa 8 học kì 2 Có đáp án
- Tổng hợp câu hỏi trắc nghiệm ôn tập kì 2 Hóa 8 năm 2022
B. Một số đề thi giữa học kì 2 Hóa 8 có đáp án
- Đề thi giữa học kì 2 lớp 8 môn Hóa có đáp án
- Đề thi giữa học kì 2 môn Hóa học lớp 8 Đề 1
- Đề thi giữa học kì 2 môn Hóa học lớp 8 Đề 2
- Đề thi giữa học kì 2 môn Hóa học lớp 8 Đề 3
- Đề thi giữa học kì 2 môn Hóa học lớp 8 Đề 4
C. Đề thi giữa học kì 2 Hóa 8 một số trường trên cả nước
Đề 01
Đề thi giữa học kì 2 lớp 8 môn Hóa trường THCS Nguyễn Đình Chiểu
Bài 1: (2,0 điểm):
a) Tính phần trăm theo khối lượng mỗi nguyên cố có trong hợp chất Fe2(SO4)3;
b) Một hợp chất có gồm 3 nguyên tố là Cu; S và O; trong đó Cu và S lần lượt chiếm 40% và 20% về khối lượng, còn lại là oxi. Biết rằng trong một phân tử hợp chất có 4 nguyên tử O. Hãy xác định công thức hóa học của hợp chất trên.
Bài 2: (3,0 điểm): Hoàn thành các PTHH (ghi rõ điều kiện phản ứng nếu có):
a) P2O5 + H2O → ……………………………………………..
b) H2 + Fe2O3 →……………………………………………..
c) Mg + HCl → ……………………………………………..
d) KClO3 → ……………………………………………..
e) K + H2O → ……………………………………………..
f) CH4 + O2 → ……………………………………………..
Bài 3: (5,0 điểm): Cho 4,6 gam kim loại Na tác dụng hết với oxi.
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Tính thể tích oxi tham gia phản ứng (đktc).
c) Toàn bộ sản phẩm đem hòa tan hết trong nước thì thu được 160 gam dung dịch A. Tính nồng độ phần trăm của dung dịch A.
d) Cần thêm bao nhiêu gam Na vào A để nồng độ dung dịch tăng thêm 5%.
Đáp án đề thi giữa học kì 2 lớp 8 môn Hóa trường THCS Nguyễn Đình Chiểu
Bài 1: (2,0 điểm) Mỗi câu 1,0 điểm
a) 28%Fe; 24%S; 48%O
b) CuSO4.
Bài 2: (3,0 điểm)
Hoàn thành các phương trình hóa học (ghi rõ điều kiện phản ứng nếu có):
a) P2O5 + 3H2O →2H3PO4
b) 3H2 + Fe2O3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Fe + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2Fe + 3H2O
c) Mg + 2HCl → MgCl2 + H2
d) 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
e) 2K + 2H2O → 2KOH + H2
f) CH4 + 2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) CO2 + 2H2O
Bài 3: (4,0 điểm).
a) 0,5 điểm
4Na + O2 → 2Na2O
b) (1,5 điểm)
nNa = 0,2 mol
4Na + O2 → 2Na2O
0,2 0,05 0,1 (mol)
Suy ra: VO2 = 0,2 (1)
c) 1,5 điểm
Na2O + H2O → 2NaOH
0,1 0,2 (mol)
d) 1,5 điểm
Gọi số mol Na thêm vào dung dịch A là x (mol)
2Na + 2H2O → 2NaOH + H2
x x 0,5x (mol)
Nồng độ % của dung dịch sau khi thêm Na là: 5% + 5% = 10%
Số gam dung dịch mới là: 160 + 23x - 0,5x.2 = 160 + 22x (gam)
Từ đó suy ra: ![]() \(\frac{{8 + 40x}}{{160 + 22x}}.100\% = 10\%\)
\(\frac{{8 + 40x}}{{160 + 22x}}.100\% = 10\%\)
Tìm x = 0,212 và tính được số gam Na là 4,876 gam
Đề 02
|
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO VIỆT YÊN Thời gian làm bài: 45 phút |
ĐỀ KHẢO SÁT CHẤT LƯỢNG GIỮA HỌC KÌ II MÔN THI: HÓA HỌC 8 |
I. TRẮC NGHIỆM (3 điểm): Hãy chọn đáp án đúng trong mỗi câu sau:
Câu 1: Chất có công thức hóa học nào sau đây là oxit?
A. ZnO
B. Zn(OH)2
C. ZnCO3
D. ZnSO4
Câu 2: Đốt cháy hoàn toàn khí metan (CH4) trong khí oxi (vừa đủ). Sản phẩm của phản ứng là:
A. CO2.
B. H2O.
C. CO2 và H2O.
D. CO2, H2O và O2.
Câu 3: Cho các phương trình hóa học của các phản ứng sau:
1) CaCO3 → CaO + CO2
2) Fe + S → FeS
3) Zn + 2HCl → ZnCl2 + H2
4) 2Fe + 3Cl2 → 2FeCl3
Trong các phản ứng trên: số phản ứng hóa hợp, phản ứng phân hủy lần lượt là:
A. 3; 1.
B. 2; 1.
C. 1; 3.
D. 1; 2.
Câu 4: Thành phần thể tích của không khí gồm:
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
C. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 5: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là:
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Câu 6: Dãy chất nào sau đây gồm toàn oxit bazơ?
A. SO3; P2O5.
B. Na2O; SO3.
C. SO2; CaO.
D. Na2O; CaO.
II. TỰ LUẬN (7 điểm)
Câu 1 (1 điểm):
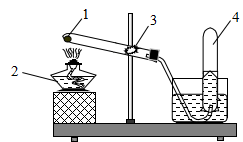
Cho hình vẽ mô tả thí nghiệm điều chế khí oxi trong phòng thí nghiệm. Hãy xác định 1, 2, 3, 4
Câu 2 (1 điểm): Giải thích tại sao: Khi nhốt một con dế mèn vào một lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn?
Câu 3 (1 điểm): Cho các oxit có công thức hóa học sau: SO2; Fe2O3. Chất nào thuộc loại oxit bazơ, chất nào thuộc loại oxit axit. Gọi tên các oxit đó?
Câu 4 (2 điểm): Hoàn thành các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng nếu có):
a) S + O2 ---> ………
b) Fe + O2 ---> ……..
c) KMnO4 ---> K2MnO4 + MnO2 + …..
d) ……… ---> KCl + O2.
Câu 5 (2 điểm): Đốt cháy hoàn toàn 2,48 gam photpho trong bình chứa khí oxi, tạo thành điphotpho pentaoxit.
a) Tính khối lượng hợp chất tạo thành?
b) Nếu trong bình chứa 4 gam khí oxi. Hỏi sau khi phản ứng kết thúc chất nào còn dư và dư bao nhiêu gam?
(Cho nguyên tử khối của các nguyên tố: P = 31; O = 16; C =12; H = 1)
Đáp án hướng dẫn giải giải đề thi
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | A | C | B | A | C | D |
II. TỰ LUẬN (7 điểm)
| CÂU | ĐÁP ÁN | ĐIỂM |
| 1 | (1): KMnO4 hoặc KClO3; (2): đèn cồn; (3): bông; (4): Khí oxi | 1,0 |
| 2 | Vì trong quá trình hô hấp của chúng cần oxi cho quá trình trao đổi chất (quá trình này góp phần vào sự sinh tồn của người và động vật), khi ta đậy nút kín có nghĩa là sau một thời gian trong lọ sẽ hết khí oxi để duy trì sự sống. Do đó con vật sẽ chết. | 1,0 |
| 3 |
Oxit bazơ là: Fe2O3 (Sắt (III) oxit) Oxit axit là: SO2 (Lưu huỳnh đioxit) |
0,5 0,5 |
| 4 |
a) S + O2 b) 3Fe + 2O2 c) 2KMnO4 d) 2KClO3 |
0,5 0,5 0,5 0,5 |
| 5 |
a) Số mol của P là: 4P + 5O2 Theo PTHH: 4 -------> 2 (mol) Theo bài ra: 0,08 -------> 0,04 (mol) Khối lượng P2O5 tạo thành là: => mP2O5 = 0,04.142 = 5,68 gam b) Số mol của oxi là: nO2 = 4/32 = 0,125 mol Xét tỉ lệ: 0,08/4 < 0,125/5 => O2 dư, P phản ứng hết. 4P + 5O2 Theo PTHH: 4 ------> 5 (mol) Theo bài ra: 0,08 ---> nO2 => Số mol oxi tham gia phản ứng là: nO2 = 5.0,08/4 = 0,1 (mol) => Số mol oxi còn dư sau phản ứng: (dư) = 0,125 |
0,25
0,5
0,25
0,25
0,25
0,25 |
.......................................
Ngoài Bộ đề thi giữa học kì 2 lớp 8 môn Hóa học - Số 1. Để chuẩn bị cho kì thi giữa học kì 2 sắp tới, ngoài việc ôn tập theo đề cương, các em học sinh cần thực hành luyện đề để làm quen với nhiều dạng bài khác nhau, đồng thời nắm được cấu trúc đề thi. Chuyên mục Đề thi giữa kì 2 lớp 8 với đầy đủ các môn, là tài liệu hay cho các em tham khảo, ôn tập và cũng là tài liệu hữu ích cho thầy cô tham khảo ra đề.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.




