Đề thi học sinh giỏi Hóa học 8 năm 2020 - Đề 1
Đề luyện thi học sinh giỏi Hóa 8 có đáp án
Đề thi học sinh giỏi Hóa học 8 năm 2020 - Đề 1 được VnDoc biên soạn đăng tải dưới dạng tổng hợp các câu hỏi luyện thi học sinh giỏi Hóa học 8 đi kèm có đáp án, là tài liệu luyện tập hữu ích giúp các em học sinh lớp 8. Giúp các em có thể nắm được cấu trúc, dạng bài tập sẽ xuất hiện trong đề thi học sinh giỏi.
- Đề thi lớp 8 cuối kì 2 năm 2020 môn Hóa học (số 3)
- Tổng hợp câu hỏi hay và khó trong bài thi cuối kì 2 môn Hóa học 8
- Đề thi lớp 8 cuối kì 2 năm 2020 môn Hóa học nâng cao (số 2)
|
ĐỀ THI THỬ Đề số 1 |
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC LỚP 8 Thời gian làm bài: 150 phút |
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Câu I (1,5 điểm)
1) Hoàn thành và xác định các chất có trong sơ đồ sau:
CaCl2![]() \(\overset{(1)}{\rightarrow}\) Ca
\(\overset{(1)}{\rightarrow}\) Ca ![]() \(\overset{(2)}{\rightarrow}\) CaO
\(\overset{(2)}{\rightarrow}\) CaO ![]() \(\overset{(3)}{\rightarrow}\) Ca(OH)2
\(\overset{(3)}{\rightarrow}\) Ca(OH)2 ![]() \(\overset{(4)}{\rightarrow}\) CaCO3
\(\overset{(4)}{\rightarrow}\) CaCO3 ![]() \(\overset{(5)}{\rightarrow}\) Ca(HCO3)2
\(\overset{(5)}{\rightarrow}\) Ca(HCO3)2 ![]() \(\overset{(6)}{\rightarrow}\) CO2
\(\overset{(6)}{\rightarrow}\) CO2
2) Có 4 lọ mất nhãn chứa 4 dung dịch HCl, Na2SO4, NaCl, Ba(OH)2. Chỉ dùng quì tím và các chất còn lại để xác định các dung dịch trên.
3) Từ các chất có sẵn H2, O2, HCl, Fe2O3, C2H4, Na. Viết phương trình điều chế: CO2, Fe, Na2O, FeCl3.
Câu II (2,5 điểm)
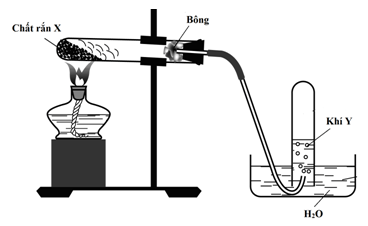
- Hình vẽ trên mô tả thí nghiệm nào đã được học?
- Em hãy cho biết tên gọi và công thức hóa học của chất X và Y trong hình vẽ trên.
- Viết phương trình hóa học điều chế khí Y.
- Tại sao lại dùng 1 miếng bông đặt ngay miệng ống nghiệm?
- Khi lắp ống nghiệm, vì sao để miệng ống nghiệm thấp hơn phần đáy?
- Người ta thu khí Y bằng phương pháp gì như hình vẽ? Dựa vào tính chất gì của khí Y ta có thể dùng phương pháp trên?
- Em hãy nêu một vài ứng dụng của khí Y trong đời sống và sản xuất.
Câu III (2,5 điểm)
1) Phân tích một hợp chất hóa học, thấy có 3 nguyên tố hóa học là C, H, và O. Đốt cháy hoàn toàn 1,24g hợp chất thì thu được 1,76g CO2 và 1,8g H2O. Xác định công thức phân tử của hợp chất, biết khối lượng mol của hợp chất bằng 62g.
2) Đốt cháy hoàn toàn cacbon bằng lượng khí oxi dư, người ta được hỗn hợp khí cacbonic và khí oxi.
a) Xác định thành phần phần trăm theo số mol của khí oxi trong hỗn hợp có 0,3.1023 phân tử CO2 và 0,9.1023 phân tử O2.
b) Trình bày phương pháp hóa học tách riêng khí oxi và khí cacbonic ra khỏi hỗn hợp.
Câu IV (1,5 điểm)
Hòa tan NaOH rắn vào nước để tạo thành hai dung dịch A và B với nồng độ phần trăm của dung dịch A gấp 3 lần nồng phần trăm của dung dịch B. Nếu đem pha trộn hai dung dịch A và B theo tỉ lệ khối lượng mA:mB = 5:2 thì thu được dung dịch C có nồng độ phần trăm là 20%. Nồng độ phần trăm của hai dung dịch A và B lần lượt là?
Câu V (2 điểm)
1) Làm bay hơi 75ml nước từ dung dịch H2SO4 có nồng độ 20% được dung dịch mới có nồng độ 25%. Hãy xác định khối lượng của dung dịch ban đầu. Biết Dnước=1g/ml.
2) Xác định khối lượng NaCl kết tinh trở lại khi làm lạnh 548g dung dịch muối ăn bão hòa ở 50oC xuống 0oC. Biết SNaCl ở 50oC là 37g và SNaCl ở 0oC là 35g.
3) Cần lấy thêm bao ml dung dịch có nồng độ 36% (D = 1,19g/ml) để pha 5 lít HCl có nồng độ ) 0,5M.
Gợi ý đáp án đề thi học sinh giỏi lớp 8
Câu I (1,5 điểm)
1)
(1): điên phân nóng chảy CaCl2
(2): O2
(3): H2O
(4): CO2
(5): CO2 + H2O
(6): Nhiệt phân
2) Dùng quì tím để nhận biết axit HCl làm quì chuyển sang đỏ, muối NaCl, Na2SO4 không làm quì đổi màu, quì chuyển sang đỏ là Ba(OH)2.
- Nhận biết 2 muối bằng cách cho Ba(OH)2 xuất hiện kết tủa trắng là Na2SO4
3)
4Na + O2 → 2Na2O
C2H4 + 3O2 → 2CO2 + 2H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Câu II (2,5 điểm)
Hình vẽ trên mô tả thí nghiệm: Điều chế khí Oxi trong phòng thí nghiệm
Tên gọi và công thức hóa học của chất X: KMnO4 (kalipenmanganat); Y: Oxi
Phần sau học sinh tự làm
Câu III (2 điểm)
1)
Dựa vào 1,24g và mC, mH tính mO
![]() \({n_{C{O_2}}} = 0,04mol = > {n_C} = 0,04mol = > {m_C} = 0,04 \times 12 = 0,48g\)
\({n_{C{O_2}}} = 0,04mol = > {n_C} = 0,04mol = > {m_C} = 0,04 \times 12 = 0,48g\)
![]() \({n_{{H_2}O}} = 0,06mol = > n_H^{} = 0,12mol = > {m_C} = 0,12 \times 1 = 0,12g\)
\({n_{{H_2}O}} = 0,06mol = > n_H^{} = 0,12mol = > {m_C} = 0,12 \times 1 = 0,12g\)
![]() \(\frac{{12x}}{{0,48}} = \frac{y}{{0,12}} = \frac{{16z}}{{0,64}} = \frac{{62}}{{1,24}}\)
\(\frac{{12x}}{{0,48}} = \frac{y}{{0,12}} = \frac{{16z}}{{0,64}} = \frac{{62}}{{1,24}}\)
Giải ra ta có:
![]() \(x = \frac{{0,48 \times 62}}{{1,24 \times 12}} = 2\);
\(x = \frac{{0,48 \times 62}}{{1,24 \times 12}} = 2\); ![]() \(y = \frac{{0,12 \times 62}}{{1,24 \times 1}} = 6\);
\(y = \frac{{0,12 \times 62}}{{1,24 \times 1}} = 6\); ![]() \(z = \frac{{0,64 \times 62}}{{1,24 \times 16}} = 2\)
\(z = \frac{{0,64 \times 62}}{{1,24 \times 16}} = 2\)
Công thức phân tử của hợp chất là C2H6O2
2)
a) Số mol các chất có trong hỗn hợp
 \(\begin{array}{l}
{n_{C{O_2}}} = \frac{{0,{{3.10}^{23}}}}{{{{6.10}^{23}}}} = 0,05mol,{n_{{O_2}}} = \frac{{0,{{9.10}^{23}}}}{{{{6.10}^{23}}}} = 0,15mol\\
\% C{O_2} = \frac{{0,05.100\% }}{{0,05 + 0,15}} = 25\% {;^{^{}}}\% {O_2} = 100 - 25\% = 75\%
\end{array}\)
\(\begin{array}{l}
{n_{C{O_2}}} = \frac{{0,{{3.10}^{23}}}}{{{{6.10}^{23}}}} = 0,05mol,{n_{{O_2}}} = \frac{{0,{{9.10}^{23}}}}{{{{6.10}^{23}}}} = 0,15mol\\
\% C{O_2} = \frac{{0,05.100\% }}{{0,05 + 0,15}} = 25\% {;^{^{}}}\% {O_2} = 100 - 25\% = 75\%
\end{array}\)
b) Tách hỗn hợp khí CO2 và O2
Cho hỗn hợp lội qua nươc vôi trong dư, khí CO2 tác dụng với Ca(OH)2 tạo kết tủa trắng CaCO3. Phương trình phản ứng:
Ca(OH)2 + CO2→ CaCO3 + H2O
Thu lại khí CO2 từ CaCO3 bằng cách lọc lấy kết tủa CaCO3. Cho CaCO3 tác dụng với H2SO4. Chất khí bay ra là khí CO2
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Câu IV (1,5 điểm)
Theo đầu bài ta có: Dung dịch A có nồng độ 3x%, dung dịch B có nồng độ x%
![]() \(\frac{{{m_A}}}{{{m_B}}} = \frac{5}{2} = 2,5 = > {m_A} = 2,5{m_B}\)
\(\frac{{{m_A}}}{{{m_B}}} = \frac{5}{2} = 2,5 = > {m_A} = 2,5{m_B}\)
Lấy dung dịch B là m gam, dung dịch A: 2,5m
mNaOH trong m gam B: ![]() \(\frac{{{m_x}}}{{100}}\) ; trong 2,5m gam A:
\(\frac{{{m_x}}}{{100}}\) ; trong 2,5m gam A: ![]() \(\frac{{2,5m \times 3x}}{{100}}\)
\(\frac{{2,5m \times 3x}}{{100}}\)
 \(\frac{{\frac{{mx}}{{100}} + \frac{{2,5m \times 3x}}{{100}}}}{{2,5m + m}} = \frac{{20}}{{100}}\)
\(\frac{{\frac{{mx}}{{100}} + \frac{{2,5m \times 3x}}{{100}}}}{{2,5m + m}} = \frac{{20}}{{100}}\)
Giải ra ta được: x = 8,24%; 3x = 24,7%
C% dung dịch A = 24,7%; C% dung dịch B: 8,24%
Câu V (2 điểm)
1) 75ml nước = 75g. Gọi m là khối lượng dung dịch ban đầu.
- Khối lượng của dung dịch sau khi làm bay hơi nước: (m - 75)
- Ta có phương trình khối lượng chất tan: ![]() \(\frac{{m \times 20}}{{100}} = \frac{{25(m - 75)}}{{100}}\)
\(\frac{{m \times 20}}{{100}} = \frac{{25(m - 75)}}{{100}}\)
Giải ra được m = 375g
2)
Làm lạnh 137g dung dịch bão hòa (từ 50oC xuống 0oC) thì khối lượng dung dịch giảm 37 -35 =2g. Như vậy có 2g kết tinh
137 gam dung dịch NaCl (từ 50oC xuống 0oC) kết tinh 2g
548 gam dung dịch NaCl (từ 50oC xuống 0oC) kết tinh xg
x = 8g
3) nHCl = 0,2 x 1 = 0,2 mol
mdd HCl 36% cần dùng là: ![]() \(\frac{{91,25 \times 100}}{{36}} = 253,47(g)\)
\(\frac{{91,25 \times 100}}{{36}} = 253,47(g)\)
![]() \(\frac{{253,47}}{{1,19}} = 213(ml)\)
\(\frac{{253,47}}{{1,19}} = 213(ml)\)
Đề thi học sinh giỏi Hóa học 8 năm 2020 - Đề 1 được VnDoc biên soạn tổng hợp các dạng bài tập phổ biến trong đề thi học sinh giỏi Hóa 8. Đề thi học sinh giỏi Hóa 8 sẽ giúp các bạn luyện tập làm quen với dạng bài tập, cấu trúc đề thi để đạt kết quả cao.
Trên đây VnDoc đã giới thiệu tới các bạn Đề thi học sinh giỏi Hóa học 8 năm 2020 - Đề 1. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lí 8, Chuyên đề Sinh học 8, Chuyên đề Hóa học 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook. Để có thể nhân được tài liệu mới và sớm nhất mời bạn đọc tham gia vào nhóm Tài liệu học tập lớp 8.



