Hình dạng Orbital s
Orbital s có hình dạng gì?
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi
Cùng nhau làm bài kiểm tra khảo sát chất lượng môn Hóa 10 sách Kết nối tri thức nha!
Hình dạng Orbital s
Orbital s có hình dạng gì?
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi
Ion đa nguyên tử
Chất nào dưới đây chứa ion đa nguyên tử?
Ion đa nguyên tử là NH4+.
Số liên kết σ và π phân tử C2H4
Số liên kết σ và π có trong phân tử C2H4 lần lượt là
Liên kết đôi gồm một liên kết σ và một liên kết π; liên kết ba gồm 1 liên kết σ và hai liên kết π.
Trong phân tử C2H4, có 4 liên đơn kết C – H và 1 liên kết đôi C = C. Vì thế, số liên kết σ và π có trong phân tử C2H4 lần lượt là 5 và 1.
Chiều tăng dần sự phân cực liên kết trong phân tử
Dãy chất nào dưới đây được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử?
Độ phân cực của liên kết tăng dần theo dãy: liên kết cộng hóa trị không phân cực < liên kết cộng hóa trị phân cực < liên kết ion.
Cl2: Liên kết giữa Cl và Cl là liên kết cộng hóa trị không cực
HCl: Liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
KCl: Liên kết giữa K và Cl là liên kết ion
Chiều tăng dần sự phân cực liên kết trong phân tử là:
Cl2 < HCl < NaCl
Công thức hydroxide tương ứng của R
Công thức oxide cao nhất của R là RO3. Vậy công thức hydroxide tương ứng của R là
Trong oxide cao nhất RO3 thì R có hóa trị VI nên công thức hydroxide tương ứng của R là H2RO4
Chiều tăng dần tính phi kim
Sắp xếp các nguyên tố sau: O (Z = 8), S (Z = 16), F (Z = 9) theo chiều tăng dần tính phi kim (có giải thích ngắn gọn)
O (Z = 8): 1s22s22p4, suy ra O thuộc chu kì 2, nhóm VIA.
S (Z = 16): [Ne]3s23p4, suy ra S thuộc chu kì 3, nhóm VIA.
F (Z = 9): 1s22s22p5, suy ra F thuộc chu kì 2, nhóm VIIA.
Ta có:
O và F thuộc cùng một chu kì 2. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim F > O (1).
O và S thuộc cùng một nhóm VIA. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim O > S (2)
Từ (1) và (2)
⇒ Tính phi kim: S < O < F.
Cr có bao nhiêu electron độc thân
Nguyên tố Chromium (Cr) có số hiệu nguyên tử là 24. Ở trạng thái cơ bản, Cr có bao nhiêu electron độc thân?
Cấu hình electron nguyên tử:
Cr (z = 24): 1s22s22p63s23p63d54s1
Nguyên tử Cr có 6 electron độc thân, trong đó 5 electron độc thân thuộc AO 3d, 1 electron độc thân thuộc AO 4s.
Nguyên tử chứa những hạt mang điện
Nguyên tử chứa những hạt mang điện là
Nguyên tử chứa những hạt mang điện là proton mang điện tích dương và electron mang điện tích âm.
Quá trình tạo thành ion O2-
Quá trình tạo thành ion O2- nào sau đây là đúng?
Cấu hình electron của nguyên tử O là 1s2 2s2 2p4.
⇒ Số electron lớp ngoài cùng của oxi là 6.
Để đạt cấu hình electron bền vững của khí hiếm gần nhất là Ne, nguyên tử oxi có xu hướng nhận thêm 2 electron để tạo thành ion O2-.
O + 2e ⟶ O2-
⇒ Cấu hình electron của ion O2- là 1s22s22p6.
Cấu hình electron của nguyên tử nguyên tố X
Nguyên tố X ở chu kì 3, nhóm IA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
Nguyên tố X ở chu kì 3 ⇒ Có 3 lớp electron.
Nguyên tố X thuộc nhóm IA ⇒ Lớp ngoài cùng có 1 electron.
⇒ 1s22s22p63s1
Độ bền liên kết giảm dần từ trái sang phải
Năng lượng của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí. Giá trị năng lượng của một liên kết hóa học là thước đo độ bền liên kết. Năng lượng liên kết của các phân tử được liệt kê trong bảng sau:
|
Liên kết |
Năng lượng liên kết (KJ/mol) |
|
Cl-Cl |
242 |
|
Br-Br |
192 |
|
I-I |
150 |
Độ bền liên kết giảm dần từ trái sang phải của các phân tử Cl2, Br2, I2 là
Năng lượng càng lớn thì liên kết đó càng bền.
⇒ Độ bền liên kết giảm từ Cl2 > Br2 > I2
Liên kết cộng hoá trị phân cực
Chất nào sau đây có liên kết cộng hoá trị phân cực?
Phân tử có liên kết cộng hóa trị phân cực là HCl.
Phân tử có liên kết cộng hóa trị không phân cực là O2 và N2
Phân tử có liên kết ion là MgO.
Quy tắc octet
Theo quy tắc octet, khi hình thành liên kết hóa học các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như nguyên tử khí hiếm gần kề (với 8 electron lớp ngoài cùng, riêng He có 2 electron lớp ngoài cùng).
Xác định số hạt electron
Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
Xét nguyên tử nguyên tố A:
+ Hạt nhân của nguyên tử có 24 hạt ⇒ số proton + số neutron = 24.
+ Số hạt không mang điện là 12 ⇒ số neutron là 12.
Vậy nguyên tử A có số electron = số proton = 24 – 12 = 12.
Chất có nhiệt độ sôi cao nhất
Cho các chất sau: H2O, H2S, CH4, NH3. Biết độ âm điện của O, S, C, N lần lượt là 3,44; 2,58; 2,55; 3,04. Chất nào có nhiệt độ sôi cao nhất?
Vì H2O và NH3 có liên kết hydrogen nên nhiệt độ sôi cao hơn 2 chất còn lại
Nhưng phân tử nước phân cực hơn nên nhiệt độ sôi cao hơn
Ngoại lệ với quy tắc octet
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Trong phân tử BF3, nguyên tử B mới chỉ có 6 electron ở lớp ngoài cùng, chưa đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Đồng vị của cùng một nguyên tố hóa học
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
có cùng số proton nên cùng là đồng vị của một nguyên tố hóa học
Liên kết hydrogen
Chất nào sau đây không thể tạo được liên kết hydrogen
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Vậy CH4 không thể tạo được liên kết hydrogen.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Cho 2 nguyên tố Sodium (Natri, 11Na) và Aluminium (Nhôm, 13Al).
a) Hai nguyên tố Na, Al đều thuộc chu kì 3. Đúng||Sai
b) Dựa vào mức độ phản ứng của Na và Al với nước ở điều kiện thường, có thể so sánh được độ hoạt động giữa Na với Al. Đúng||Sai
c) Tính base của sodium hydroxide yếu hơn tính base của Aluminium hydroxide. Sai||Đúng
d) Sodium oxide và Aluminium oxide đều tác dụng với dung dịch HCl và NaOH. Sai||Đúng
Cho 2 nguyên tố Sodium (Natri, 11Na) và Aluminium (Nhôm, 13Al).
a) Hai nguyên tố Na, Al đều thuộc chu kì 3. Đúng||Sai
b) Dựa vào mức độ phản ứng của Na và Al với nước ở điều kiện thường, có thể so sánh được độ hoạt động giữa Na với Al. Đúng||Sai
c) Tính base của sodium hydroxide yếu hơn tính base của Aluminium hydroxide. Sai||Đúng
d) Sodium oxide và Aluminium oxide đều tác dụng với dung dịch HCl và NaOH. Sai||Đúng
Cấu hình electron nguyên tử Na (z = 11): 1s22s22p63s1
+ Na thuộc chu kì 3, nhóm IA nên Na có hóa trị trong oxide cao nhất là 1.
+ Công thức oxide cao nhất là Na2O ⇒ basic oxide
+ Công thức hydroxide NaOH ⇒ là base mạnh
Cấu hình electron nguyên tử Al (Z = 13): 1s22s22p63s23p1
Al thuộc chu kì 3, nhoám IIIA nên Al có hóa trị trong oxide cao nhất là 3.
+ Công thức oxide cao nhất là Al2O3 ⇒ Oxide lưỡng tính
+ Công thức hydroxide Al(OH)3 ⇒ base lưỡng tính
a) Đúng
Mô hình (1) là mô hình nguyên tử theo Rutherford – Bohr, mô hình (2) là mô hình nguyên tử hiện đại.
b) Đúng
Na phản ứng được với nước ở nhiệt độ thường, Al không phản ứng với nước ở nhiệt độ thường
c) Sai Vì
Tính base của sodium hydroxide mạnh hơn tính base của Aluminium hydroxide.
d) Sai Vì
Al2O3 có tính lưỡng tính: tác dụng được với cả dung dịch acid và dung dịch base.
Còn Na2O không tác dụng với dung dịch NaOH.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
X là nguyên tố hóa học được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da . Nguyên tử của nguyên tố Y có số hạt mang điện tích dương là 16.
a) X là phi kim. Đúng||Sai
b) X có xu hướng nhận thêm 2 electron để đạt cấu hình electron bền vững giống khí hiếm. Đúng||Sai
c) Công thức hydroxide cao nhất của X là HXO4. Sai||Đúng
d) Trong hợp chất XO2 có chứa 1 liên kết cho - nhận. Đúng||Sai
X là nguyên tố hóa học được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da . Nguyên tử của nguyên tố Y có số hạt mang điện tích dương là 16.
a) X là phi kim. Đúng||Sai
b) X có xu hướng nhận thêm 2 electron để đạt cấu hình electron bền vững giống khí hiếm. Đúng||Sai
c) Công thức hydroxide cao nhất của X là HXO4. Sai||Đúng
d) Trong hợp chất XO2 có chứa 1 liên kết cho - nhận. Đúng||Sai
Nguyên tử của nguyên tố Y có số hạt mang điện tích dương là 16
⇒ X có số p = số e = 16.
⇒ Cấu hình electron của chlorine là 1s22s22p63s23p4.
⇒ Nguyên tử X có 3 lớp electron và 6 electron lớp ngoài cùng.
⇒ X là phi kim
X thuộc nhóm VIA trong bảng tuần hoàn, có hoá trị cao nhất trong hợp chất hydroxide là VI.
Công thức oxide cao nhất của X là: XO3
Công thức hydroxide cao nhất của X là H2XO4 là acid mạnh
a) Đúng.
b) Đúng
c) Sai vì
Công thức hydroxide cao nhất của X là H2XO4.
d) Đúng
+ O có cấu hình electron là 1s22s22p4 ⇒ O có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình bền vững của khí hiếm.
+ X có cấu hình electron là 1s22s22p63s23p4 ⇒ S có 6 elctron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình bền vững của khí hiếm.
+ Khi hình thành phân tử, một nguyên tử O góp chung 2 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
Nguyên tử O còn lại chưa được liên kết. Trong khi đó nguyên tử X vẫn còn 2 đôi electron chưa tham gia liên kết.
⇒ Nguyên tử X sẽ cho nguyên tử O chưa tham gia liên kết 1 cặp electron để dùng chung được gọi là liên kết cho nhận.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z =9), Cl (Z= 17) , Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tại dạng phân tử X2, giữa các phân tử X2 thường có tương tác với nhau.
a) Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2np5. Đúng||Sai
b) Tương tác giữa các phân tử X2 là tương tác van der Waals. Đúng||Sai
c) Liên kết giữa các nguyên tử X2 là liên kết cộng hóa trị không phân cực. Đúng||Sai
d) Chất có nhiệt độ sôi cao nhất là F2. Sai||Đúng
Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z =9), Cl (Z= 17) , Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tại dạng phân tử X2, giữa các phân tử X2 thường có tương tác với nhau.
a) Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2np5. Đúng||Sai
b) Tương tác giữa các phân tử X2 là tương tác van der Waals. Đúng||Sai
c) Liên kết giữa các nguyên tử X2 là liên kết cộng hóa trị không phân cực. Đúng||Sai
d) Chất có nhiệt độ sôi cao nhất là F2. Sai||Đúng
a) Đúng
b) Đúng
c) Đúng
d) Sai vì
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
Số electron (và proton) trong phân tử tăng theo thứ tự: F2 < Cl2 < Br2 < I2
⇒ I2 có số electron (số proton) lớn nhất ⇒ Nhiệt độ sôi cao nhất.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 kJ mol-1; H–Br là 364 kJ mol-1; H–I là 297 kJ mol-1.
a) HF, HCl, HBr, HI tạo được liên kết hydrogen với các phân tử cùng loại. Sai||Đúng
b) Khi đun nóng, HI bị phân hủy (thành H2và I2) ở nhiệt độ thấp hơn so với HBr (thành H2và Br2). Đúng||Sai
c) Liên kết H – I là bền vững hơn so với liên kết H – Br. Sai||Đúng
d) Độ dài liên kết của H-Cl lớn hơn của H-Br. Sai||Đúng
Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 kJ mol-1; H–Br là 364 kJ mol-1; H–I là 297 kJ mol-1.
a) HF, HCl, HBr, HI tạo được liên kết hydrogen với các phân tử cùng loại. Sai||Đúng
b) Khi đun nóng, HI bị phân hủy (thành H2và I2) ở nhiệt độ thấp hơn so với HBr (thành H2và Br2). Đúng||Sai
c) Liên kết H – I là bền vững hơn so với liên kết H – Br. Sai||Đúng
d) Độ dài liên kết của H-Cl lớn hơn của H-Br. Sai||Đúng
a) Sai vì
Chỉ có HF mới tạo được liên kết hydrogen với các phân tử cùng loại; còn HCl, HI, HBr, thì không.
b) Đúng.
c) Sai vì
Giá trị năng lượng liên kết là thức đo độ bền liên kết nên năng lượng liên kết càng lớn thì liên kết càng bền.
→ So sánh độ bền liên kết: H–F > H–Cl > H–Br > H–I.
d) Sai vì
Liên kết càng bền thì độ dài liên kết càng ngắn
Độ dài liên kết HCl ngắn hơn của HBr.
Điền vào chỗ trống câu trả lời ngắn
Cho các chất sau: (1) H2S; (2) SO2; (3) NaCl; (4) CaO; (5) NH3; (6) HBr; (7) CO2; (8) K2S. Số chất có liên kết cộng hóa trị?
Cho các chất sau: (1) H2S; (2) SO2; (3) NaCl; (4) CaO; (5) NH3; (6) HBr; (7) CO2; (8) K2S. Số chất có liên kết cộng hóa trị?
Các chất có liên kết cộng hóa trị là:
(1) H2S; (2) SO2; (5) NH3; (6) HBr; (7) CO2;
Các chất còn lại có liên kết ion.
Điền vào chỗ trống câu trả lời ngắn
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là 4 cặp electron.
Điền vào chỗ trống câu trả lời ngắn
Cho 1,2 g kim loại M thuộc nhóm IIA tác dụng hết với dung dịch HCl dư thu được 0,7437 L khí (đo ở 25oC và 1 bar. Biết 1 mol khí ở điều kiện này chiếm thể tích là 24,79 lit). Xác định tên kim loại M.
Cho 1,2 g kim loại M thuộc nhóm IIA tác dụng hết với dung dịch HCl dư thu được 0,7437 L khí (đo ở 25oC và 1 bar. Biết 1 mol khí ở điều kiện này chiếm thể tích là 24,79 lit). Xác định tên kim loại M.
nH2 = 0,7437:24,79 = 0,03 mol
Phương trình tổng quát
M + 2HCl → MCl2 + H2↑
Số mol M = số mol khí = 0,03
⇒ M = 1,20,031,20,03 = 40 (g/mol).
M là Ca.
Điền vào chỗ trống câu trả lời ngắn
Bromine (Br, Z = 35) là chất lỏng màu nâu đỏ, dễ bay hơi, mùi khó chịu và độc. Do nguyên tố này có tính ổn định thấp hơn khi tiếp xúc với ánh sáng. Do đó hóa chất hồ bơi này không thực sự phù hợp để xử lý nước bể bơi ngoài trời. Thay vào đó chỉ nên sử dụng cho những bể bơi trong nhà hay bể bơi có mái che. Dựa vào phổ khối lượng của Bromine trong tự nhiên. Hãy tính nguyên tử khối trung bình của Bromine
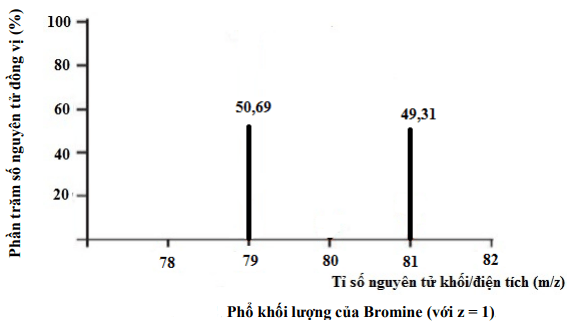
Bromine (Br, Z = 35) là chất lỏng màu nâu đỏ, dễ bay hơi, mùi khó chịu và độc. Do nguyên tố này có tính ổn định thấp hơn khi tiếp xúc với ánh sáng. Do đó hóa chất hồ bơi này không thực sự phù hợp để xử lý nước bể bơi ngoài trời. Thay vào đó chỉ nên sử dụng cho những bể bơi trong nhà hay bể bơi có mái che. Dựa vào phổ khối lượng của Bromine trong tự nhiên. Hãy tính nguyên tử khối trung bình của Bromine

Ta có:
Br có 2 đồng vị bền là
Nguyên tử khối trung bình của Mg:
=
Điền vào chỗ trống câu trả lời ngắn
Oxide cao nhất của nguyên tố R là RO. Trong oxide này, R chiếm 60% về khối lượng. Hoà tan hoàn toàn 9,6 gam R bằng dung dịch HCl 29,2% vừa đủ thu được khí H2 và dung dịch M. Tính nồng độ phần trăm của chất tan trong dung dịch M.
Oxide cao nhất của nguyên tố R là RO. Trong oxide này, R chiếm 60% về khối lượng. Hoà tan hoàn toàn 9,6 gam R bằng dung dịch HCl 29,2% vừa đủ thu được khí H2 và dung dịch M. Tính nồng độ phần trăm của chất tan trong dung dịch M.
Oxide cao nhất của X là XO
=> R = 24, X là Mg
nMg = 9,6 : 24 = 0,4 mol
Phương trình phản ứng:
Mg + 2HCl → MgCl2 + H2
0,4 → 0,8 → 0,4 → 0,4 mol
mHCl = 0,8.36,5 = 29,2 gam
mMgCl2 = 0,4.95 = 38 gam
m (dung dịch M) = mMg + mdd HCl – mH2 = 9,6 + 100 – 0,4.2 = 108,8 gam
Điền vào chỗ trống câu trả lời ngắn
Hợp chất A có dạng M2X. Trong phân tử A, tổng số hạt proton là 46 và nguyên tố M chiếm 82,98% về khối lượng. Trong hạt nhân nguyên tử M có số hạt neutron nhiều hơn số hạt proton là 1 hạt, trong hạt nhân nguyên tử X có số hạt mang điện bằng số hạt không mang điện. Xác định công thức hợp chất A và dự đoán loại liên kết trong hợp chất A
Hợp chất A có dạng M2X. Trong phân tử A, tổng số hạt proton là 46 và nguyên tố M chiếm 82,98% về khối lượng. Trong hạt nhân nguyên tử M có số hạt neutron nhiều hơn số hạt proton là 1 hạt, trong hạt nhân nguyên tử X có số hạt mang điện bằng số hạt không mang điện. Xác định công thức hợp chất A và dự đoán loại liên kết trong hợp chất A
Tổng số proton trong hợp chất là 46
2ZM + ZX = 46 (1)
Trong hạt nhân của M, số hạt không mang điện nhiều hơn số hạt mang điện là
NM = ZM + 1 (2)
Trong hạt nhân của X , số hạt không mang điện bằng số hạt mang điện
NX = PX (3)
Từ (2); (3) ta được:
2NM + NY = 2ZM + 2 + ZX
⇒ 2NM + NY = 46 + 2= 48 (4)
Nguyên tử khối của A: MA = ZA + NA = 2ZM + ZX + 2NM + NY = 46 + 48 = 94
Trong hợp chất A, khối lượng của M chiếm 82,98%
⇒ MM = 39 (K)
⇒ 2.39 + MX = 94 ⇒ MX = 16 (O)
Vậy công thức phân tử của A là: K2O
K2O là hợp chất tạo bởi kim loại điển hình và phi kim điển hình, suy ra liên kết giữa K và O trong hợp chất này là liên kết ion, hợp chất này là hợp chất ion.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
