Nhiệt lượng tỏa ra hay thu vào của phản ứng
Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là
Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra ở một điều kiện xác định.
Cùng nhau thử sức với bài kiểm tra 15 phút Hóa 10 Chương 5. Năng lượng hóa học.
Nhiệt lượng tỏa ra hay thu vào của phản ứng
Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là
Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra ở một điều kiện xác định.
Phương trình hóa học kèm theo trạng thái của các chất
Phương trình hóa học kèm theo trạng thái của các chất và giá trị ![]() rH gọi là
rH gọi là
Phương trình hóa học kèm theo trạng thái của các chất và giá trị rH gọi là phương trình nhiệt hóa học.
Phản ứng thu nhiệt, phản ứng tỏa nhiệt
Cho hai phương trình nhiệt hóa học sau:
C(s) + H2O(g) ![]() CO(g) + H2(g)
CO(g) + H2(g) ![]()
CuSO4 (aq) + Zn(s) → ZnSO4(aq) + Cu(s)![]()
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
Phản ứng (1) thu nhiệt có > 0 nên đây là phản ứng thu nhiệt
Phản ứng (2) tỏa nhiệt có < 0 nên đây là phản ứng tỏa nhiệt
Chọn so sánh đúng
Cho phương trình nhiệt hóa học sau:
2H2(g) + O2(g) ⟶ 2H2O(g) ![]() = −483,64 kJ
= −483,64 kJ
So sánh đúng là:
Ta có: = ∑
(sp) – ∑
(cđ)
mà = −483,64 kJ < 0
⇒ ∑(sp) < ∑
(cđ)
Công thức tính biến thiên enthalpy
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết của phản ứng: H2 (g) + Cl2(g) → 2HCl (g)
Phản ứng:
H-H (g) + Cl-Cl(g) → 2H-Cl (g)
Biến thiên enthalpy chuẩn của phản ứng là
Tính khối lượng CH4 cần đem đi đốt cháy
Cho các phản ứng sau xảy ra ở điều kiện chuẩn:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = -890,36 kJ
= -890,36 kJ
CaCO3(s) → CaO(s) + CO2(s) ![]() = 178,29 kJ
= 178,29 kJ
Ở điều kiện tiêu chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Ta có:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) = -890,36 kJ
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol CH4, sản phẩm là CO2(g) và H2O(l) thì sẽ giải phóng một nhiệt lượng là 890,36 kJ.
CaCO3(s) → CaO(s) + CO2(s) = 178,29 kJ
Để thu được 1 mol CaO(s), cần phải cung cấp nhiệt lượng là 178,29 kJ để chuyển 1 mol CaCO3(s) thành CaO (s).
Vậy ở điều kiện tiêu chuẩn, để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3 cần đốt cháy:
mCH4 = 0,4.16 = 6,4 gam
Tính biến thiên enthalpy chuẩn của phản ứng
Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + I2(s) → 2HI(g)
biết Eb(H–H) = 436 kJ/mol, Eb(I–I) = 151 kJ/mol, Eb(H–I) = 297 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng là:
= Eb(H–H) + Eb(I–I) – 2×Eb(H–I)
= 436 + 151 – 2×297
= –7 (kJ).
Tìm phát biểu đúng
Cho phản ứng sau: 2H2(g) + O2(g) → 2H2O(g) ![]() = –483,64 kJ. Phát biểu nào sau đây đúng?
= –483,64 kJ. Phát biểu nào sau đây đúng?
- Phản ứng có = –483,64 kJ < 0 ⇒ Phản ứng tỏa nhiệt.
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
⇒ Phát biểu đúng là: Nhiệt tạo thành chuẩn của H2O là –241,82 kJ/mol.
Methane (CH4) được sử dụng làm nhiên liệu
Methane (CH4) được sử dụng làm nhiên liệu, nguyên nhân chính là do methane
Giá trị enthalpy
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe (s) + 4H2O (l) → Fe3O4 (s) + 4H2 (g) = +26,32 kJ
Giá trị ![]() của phản ứng:
của phản ứng:
Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) là
Khi đảo chiều phản ứng thì giá trị cũng là giá trị đối so với giá trị ban đầu
Tính biến thiên enthalpy phản ứng theo năng lượng liên kết
Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết.
Phương trình nhiệt hóa học của quá trình tạo thành silver bromide
Biết sự tạo thành 1 mol silver bromide tỏa ra 99,51 kJ nhiệt. Phương trình nhiệt hóa học của quá trình tạo thành bạc bromide từ đơn chất bền tương ứng là
- Nhiệt tạo thành chuẩn có kí hiệu là .
- Để tạo thành 2 mol AgBr sẽ tỏa ra 2.99,51 = 199,02 kJ nhiệt.
Tính lượng nhiệt tỏa ra
Phương trình nhiệt hoá học:
3H2 (g) + N2 (g) → 2NH3 (g) ![]() = - 91,80 kJ
= - 91,80 kJ
Lượng nhiệt toả ra khi dùng 9 gam H2 (g) để tạo thành NH3 (g) là
9 gam H2 tương đương với 4,5 mol.
Theo đề bài, phản ứng của 3 mol H2 thể khí với 1 mol N2 thể khí tạo 2 mol NH3 thể khí giải phóng 91,8 kJ nhiệt.
Vậy phản ứng của 9 gam H2 (tương đương với 4,5 mol) ở thể khí tạo thành NH3 ở thể khí giải phóng:
Nhận định đúng
Chọn câu trả lời đúng
Enthalpy tạo thành chuẩn của một đơn chất bền?
Enthalpy tạo thành chuẩn của một đơn chất bền bằng 0.
Dãy các chất có nhiệt tạo thành chuẩn bằng 0
Đâu là dãy các chất có nhiệt tạo thành chuẩn bằng 0?
Tìm kết luận đúng
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 (g) + O2 (g) ⟶ 2NO (g) ![]() = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
N2(g) + O2(g) ⟶ 2NO(g) = +180 kJ
Ta thấy < 0
Phản ứng thu nhiêt, phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Tính chất của enthalpy
Cho các phát biểu sau:
(1) Điều kiên chuẩn là điều kiện ứng với 1 bar (đối với chất khí).
(2) Tính chất của enthalpy đặc trưng cho 1 hệ riêng biệt.
(3) Ý nghĩa của enthalpy là xác định hiệu ứng nhiệt trong quá trình phản ứng.
(4) Nhiệt sinh của 1 chất là nhiệt sinh ra khi tạo thành 1 mol chất.
Số phát biểu sai là:
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Tính chất enthalpy: thuộc tính khuếch độ của hệ phụ thuộc khối lượng của hệ, hàm trạng thái.
Ý nghĩa của enthalpyl là xác định hiệu ứng nhiệt trong quá trình đẳng áp, đẳng nhiệt.
Nhiệt sinh ra của 1 chất là nhiệt sinh ra khi tạo thành 1 mol chất từ các đơn chất ở trạng thái bền ở điều kiện chuẩn.
Xác định giá trị
Cho phản ứng sau đây là phản ứng thu nhiệt:
CH4 (g) + H2O (l) → CO (g) + 3H2 (g)
Giá trị ![]() nào sau đây là đúng?
nào sau đây là đúng?
Vì phản ứng thu nhiệt nên > 0 ⇒
= 250 kJ.
Xác định phương trình nhiệt hóa học ứng với sơ đồ
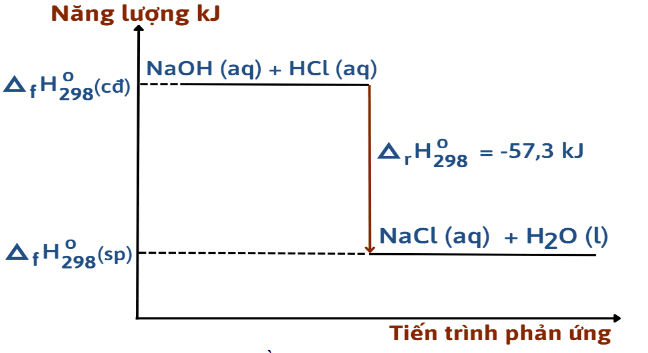
Dựa vào sơ đồ ta có phương trình nhiệt hóa học ứng với sơ đồ trên là:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) = -57,3 kJ.
Điền vào chỗ trống câu trả lời ngắn
Cho một số phương trình nhiệt hóa học sau?
(1) CS2 (l) + 3O2 (g) → 2SO2 (g) + CO2 (g) ![]()
(2) 2NaHCO3(s) → Na2CO3(s) + H2O (l) + CO2(g) ![]()
(3) 2Na (s) + 2H2O (l) →2NaOH(aq) + H2 (s) ![]()
(4) ZnSO4 (s) → ZnO(s) + SO2 (g) ![]()
(5) 4NH3(g) + 3O2(g) → 2N2 (g) + 6H2O(l) ![]()
Số quá trình tỏa nhiệt là bao nhiêu?
Cho một số phương trình nhiệt hóa học sau?
(1) CS2 (l) + 3O2 (g) → 2SO2 (g) + CO2 (g) ![]()
(2) 2NaHCO3(s) → Na2CO3(s) + H2O (l) + CO2(g) ![]()
(3) 2Na (s) + 2H2O (l) →2NaOH(aq) + H2 (s) ![]()
(4) ZnSO4 (s) → ZnO(s) + SO2 (g) ![]()
(5) 4NH3(g) + 3O2(g) → 2N2 (g) + 6H2O(l) ![]()
Số quá trình tỏa nhiệt là bao nhiêu?
Phản ứng (1); (3); (5) có là phản ứng tỏa nhiệt
Phản ứng(2); (4) có phản ứng thu nhiệt
Vậy có 3 quá trình tỏa nhiệt
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
