Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
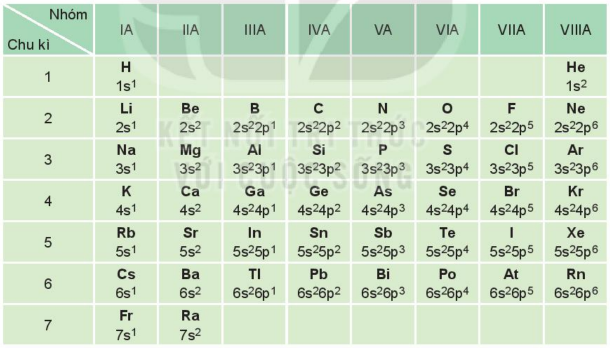
Nhóm A gồm các nguyên tố s và p. Nguyên tử của các nguyên tố cùng một nhóm A có số electron ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA)
Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
Sau mỗi chu kì, cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
II. Bán kính nguyên tử
Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm.
Xu hướng biến đổi bán kính nguyên tử:
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
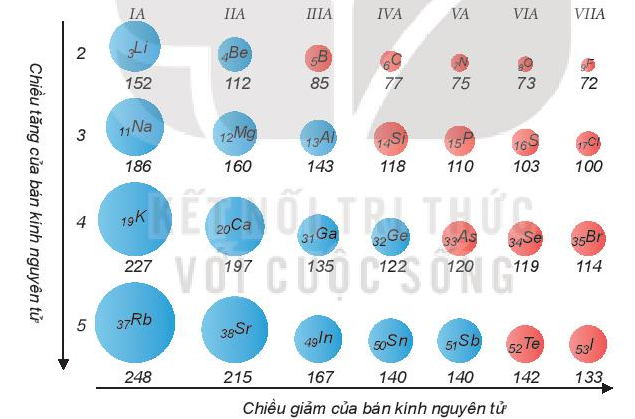
Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Hướng dẫn giải
Cấu hình electron của nguyên tử:
Lithium (Z = 3): 1s22s1 → Lithium thuộc chu kì 2, nhóm IA.
Potassium (Z = 19): 1s22s22p63s23p64s1 → Potassium thuộc chu kì 4, nhóm IA.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
⇒ Bán kính của nguyên tử lithium nhỏ hơn bán kính nguyên tử potassium.
III. Độ âm điện
Độ âm điện của nguyên tử (![]() \(\chi\)) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
\(\chi\)) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
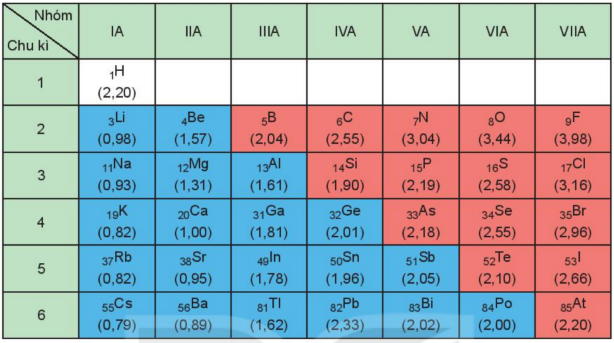
Bảng giá tị độ âm điện tương đổi theo L.C.Pauling
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
Ví dụ: Cho nguyên tử các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). So sánh độ âm điện của X, Y, T.
Hướng dẫn
Cấu hình electron của nguyên tử các nguyên tố:
X (Z = 11): 1s22s22p63s1 ⇒ X nằm ở ô số 11, chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 ⇒ Y nằm ở ô số 13, chu kì 3, nhóm IIIA.
T (Z = 17): 1s22s22p63s23p5 ⇒ T nằm ở ô số 17, chu kì 3, nhóm VIIA.
⇒ X, Y, T đều thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
⇒ So sánh độ âm điện: X < Y < T.
Ví dụ 2: So sánh độ âm điện của các nguyên tố sau: Mg, Ca, P và S.
Hướng dẫn
Ta thấy Mg và Ca cùng thuộc nhóm IIA mà độ âm điện giảm từ trên xuống dưới trong một nhóm A ⇒ ![]() \(\chi_{Ca\;<\;}\chi_{Mg}\) (*)
\(\chi_{Ca\;<\;}\chi_{Mg}\) (*)
Mg, P và S cùng thuộc chu kì 3 mà độ âm điện tăng từ trái qua phải trong một chu kì ⇒ ![]() \(\chi_{Mg<\hspace{0.278em}}\chi_P<\chi_S\)
\(\chi_{Mg<\hspace{0.278em}}\chi_P<\chi_S\)
Từ (*) và (**) ta có thể sắp xếp các nguyên tố trên theo thứ tự độ âm điện tăng dần là ![]() \(\chi_{Ca}<\chi_{Mg}<\chi_P<\chi_S\)
\(\chi_{Ca}<\chi_{Mg}<\chi_P<\chi_S\)
IV. Tính kim loại và tính phi kim
1. Khái niệm
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành ion âm, tính phi kim của nguyên tố đó càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
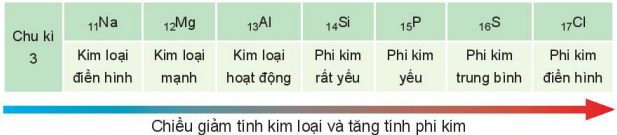
Ví dụ 1:
Ví dụ 2: Cho nguyên tử các nguyên tố X (Z = 9), Y (Z = 15), T (Z = 17). So sánh tính phi kim của X, Y, T.
Hướng dẫn
Cấu hình electron nguyên tử:
X (Z = 9): 1s22s22p5 → X thuộc chu kì 2, nhóm VIIA.
Y (Z = 15): 1s22s22p63s23p3 → Y thuộc chu kì 3, nhóm VA.
T (Z = 17): 1s22s22p63s23p5 → T thuộc chu kì 3, nhóm VIIA.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng tăng dần.
→ Tính phi kim: Y < T (Y, T cùng thuộc chu kì 3).
Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng giảm dần.
→ Tính phi kim: X > T (X, T cùng thuộc nhóm VIIA).
Vậy: Tính phi kim tăng dần là Y < T < X.





