Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron
Cùng nhau làm bài kiểm tra giữa kì 1 Hoá 10 Kết nối tri thức theo chương trình mới nhé các bạn!
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron
Số hiệu nguyên tử cho biết thông tin nào sau đây?
Số hiệu nguyên tử cho biết Số proton.
Nguyên tố X có 3 lớp electron và có 7 electron ở lớp ngoài cùng. Số hiệu nguyên tử của X là
Cấu hình electron của X là: 1s22s22p63s23p5
X có 17 electron
Trong bảng tuần hoàn, các nguyên tố ở nhóm IVA có số electron lớp ngoài cùng là
Các nguyên tử thuộc nhóm IVA có 4 electron lớp ngoài cùng
Cấu hình electron nào sau đây thuộc về nguyên tố kim loại?
Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.
1s22s22p63s23p1 → 1 e lớp ngoài cùng → là kim loại.
Kí hiệu phân lớp nào sau đây không đúng?
Lớp thứ nhất có 1 phân lớp là 1s.
Lớp thứ hai có 2 phân lớp là 2s và 2p.
Lớp thứ ba có 3 phân lớp là 3s, 3p và 3d.
Lớp thứ 4, 5, 6, 7 có 4 phân lớp là s, p, d và f.
⇒ Kí hiệu phân lớp không đúng là 2d.
Trong bảng tuần hoàn các nguyên tố hóa học, khí hiếm nằm ở nhóm
Các nguyên tố khí hiếm nằm ở nhóm VIIIA.
Một ion M3+ có tổng số hạt proton, neuton, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là:
Gọi số hạt proton, nơtron và electron trong M lần lượt là p, n và e.
Tổng số các loại hạt proton, nơtron và electron của ion M3+ là 79
p + n + e – 3 = 79 ⇒ 2p + n = 82 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 19
p + e – 3 – n = 19 hay 2p – n = 22 (2)
Từ (1), (2) ta có p = e = 26, n =30
Cấu hình e của M: [Ar]3d64s2
Phát biểu nào sau đây đúng?
Các electron trên cùng một lớp có năng lượng gần bằng nhau, trên cùng một phân lớp có năng lượng bằng nhau
Lớp M (n = 3) có số electron tối đa bằng 2.32 =18 electron
Theo trình tự sắp xếp, lớp K (n = 1) là lớp gần hạt nhân nhất. Năng lượng của electron trên lớp này là thấp nhất
Cấu hình electron của nguyên tử Iron là 1s22s22p63s23p63d64s2. Vị trí của Iron trong bảng tuần hoàn là
Từ cấu hình electron của Fe ta thấy:
Có 26 electron ⇒ Fe thuộc ô số 26 trong bảng tuần hoàn
Có 4 lớp electron ⇒ Fe thuộc chu kì 4
Cấu hình electron phân lớp ngoài cùng và sát ngoài cùng là 3d64s2 ⇒ Fe thuộc nhóm VIIIB.
Nguyên tố nào sau đây có tính chất hóa học tương tự như nguyên tố Sodium (Z=11)?
Sodium: 1s22s22p63s1
Potassium: 1s22s22p63s23p64s1
Sodium (Z = 11), potassium (Z = 19) cùng thuộc nhóm IA nên có tính chất hóa học tương tự nhau.
Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Vị trí của X trong bảng tuần hoàn là
Cấu hình e của X là 1s22s22p63s23p2 ⇒ có 14 electron nên ở ô số 14
⇒ có 4e lớp ngoài cùng ⇒ nhóm IVA
Có 3 lớp electron ⇒ chu kì 3
Orbital nguyên tử (AO) là
Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Tổng số electron tối đa chứa trong phân lớp p là:
Tổng số electron tối đa chứa trong phân lớp p là 6.
Cho các phát biểu về nguyên tử :
(1) X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
(2) X có số hạt neutron nhiều hơn proton là 4.
(3) X có 4 lớp electron.
(4) Cấu hình electron của X là [Ar]3d44s2.
(5) X là kim loại.
Số phát biểu đúng là:
Từ suy ra Z = p = e = 24; A = 52; n = 52 – 24 = 28
Cấu hình e của X: [Ar]3d54s1
(1) Ta có: p + e − n = 24 + 24−28 = 20, suy ra (1) đúng.
(2) Ta có: n – p = 28 − 24 = 4, suy ra (2) đúng.
(3) Từ cấu hình e ta thấy X có 4 lớp e, suy ra (3) đúng.
(4) Cấu hình e rút gọn của X là: [Ar]3d54s1 suy ra (4) sai.
(5) Nhận thấy X thuộc nhóm VIB nên X là kim loại, suy ra (5) đúng.
Vậy tổng có 4 phát biểu đúng.
Trong thiên nhiên Ag có hai đồng vị (56%). Tính số khối của đồng vị thứ hai. Biết nguyên tử khối trung bình của Ag là 107,88 u.
Gọi số khối đồng vị thứ 2 của Ag là M
⇒ M = 109 u
Mỗi orbital nguyên tử chứa tối đa
Mỗi orbital nguyên tử chứa tối đa 2 electron
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lý hay quy tắc nào sau đây?
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí vững bền và quy tắc Hund.
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
+ Quy tắc Hund: Trong cùng một lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Xét phát biểu về các hạt trong nguyên tử:
a. Nguyên tử gồm ba loại hạt cơ bản là proton, neutron, electron.Đúng||Sai
b. Hạt mang điện trong nguyên tử là proton và electron. Đúng||Sai
c. Hạt không mang điện trong nghiên tử là electron. Sai||Đúng
d. Hạt mang điện tích dương trong hạt nhân là proton.Đúng||Sai
Xét phát biểu về các hạt trong nguyên tử:
a. Nguyên tử gồm ba loại hạt cơ bản là proton, neutron, electron.Đúng||Sai
b. Hạt mang điện trong nguyên tử là proton và electron. Đúng||Sai
c. Hạt không mang điện trong nghiên tử là electron. Sai||Đúng
d. Hạt mang điện tích dương trong hạt nhân là proton.Đúng||Sai
a. Nguyên tử gồm ba loại hạt cơ bản là proton, neutron, electron ⇒ Đúng
b. Hạt mang điện trong nguyên tử là proton và electron. ⇒ Đúng
c. Hạt không mang điện trong nghiên tử là electron. ⇒ Sai, hạt không mang điện là neutron
d. Hạt mang điện tích dương trong hạt nhân là proton. ⇒ Đúng
Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng ủa cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích Z của các ion đồng vị của magnesium đều bằng +1)
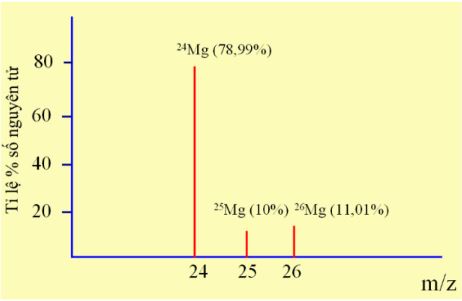
a. Magnesium có 3 đồng vị bền. Đúng||Sai
b. Phần trăm số nguyên tử của đồng vị 25Mg là lớn nhất. Sai||Đúng
c. Phần trăm số nguyên tử của đồng vị 24Mg là nhỏ nhất. Sai||Đúng
d. Nguyên tử khối trung bình của Magnesium là 24. Sai||Đúng
Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng ủa cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích Z của các ion đồng vị của magnesium đều bằng +1)

a. Magnesium có 3 đồng vị bền. Đúng||Sai
b. Phần trăm số nguyên tử của đồng vị 25Mg là lớn nhất. Sai||Đúng
c. Phần trăm số nguyên tử của đồng vị 24Mg là nhỏ nhất. Sai||Đúng
d. Nguyên tử khối trung bình của Magnesium là 24. Sai||Đúng
Magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg
Phương pháp phổ khối lượng xác nhận đồng vị 24Mg chiếm tỉ lệ phần trăm số nguyên tử lớn nhất là 78,99%. đồng vị 25Mg chiếm tỉ lệ phần trăm số nguyên tử nhỏ nhất là 10%
Nguyên tử khối trung bình của nguyên tố Mg:
Vậy
a. Magnesium có 3 đồng vị bền. ⇒ Đúng
b. Phần trăm số nguyên tử của đồng vị 25Mg là lớn nhất. ⇒ Sai
c. Phần trăm số nguyên tử của đồng vị 24Mg là nhỏ nhất. ⇒ Sai
d. Nguyên tử khối trung bình của Magnesium là 24 ⇒ Sai
Nguyên tử R có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm.
a. Hạt mang điện nhiều hơn hạt không mang điện là 16.
b. R có số khối là 35.
c. điện tích hạt nhân của R là 17.
d. R có 17 neutron.
Nguyên tử R có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm.
a. Hạt mang điện nhiều hơn hạt không mang điện là 16.
b. R có số khối là 35.
c. điện tích hạt nhân của R là 17.
d. R có 17 neutron.
Tổng số các loại hạt proton, neutron và electron của R là 52
p + n + e = 52 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17, n =18
Số khối của R: 17 + 18 = 35
Số hạt mang điện nhiều hơn số hạt không mang điện là: 17.2 – 18 = 16
Vậy:
a. Hạt mang điện nhiều hơn hạt không mang điện là 16 Đúng
b. R có số khối là 35 Đúng
c. điện tích hạt nhân của R là 17 Sai vì điện tích hạt nhân của R là +17
d. R có 17 neutron Sai vì R có 18 neutron
Orbital nguyên tử có một số hình dạng khác nhau như AO hình cầu, còn gọi là AOs, AO hình số tám nổi, còn gọi là AO p.
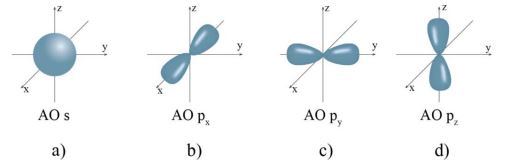
Hình dạng AO s (hình a) và AO p (hình b, c, d)
a. Các AO p trong cùng một lớp electron có kích thước và hình dạng tương tự nhau nhưng khác nhau về định hướng trong không gian. Đúng||Sai
b. Chỉ có các AO s và p, không có các AO như d và f. Sai||Đúng
c. Xác suất tìm thấy electron ở mỗi thuỳ trong hình b là khoảng 90%. Sai||Đúng
d. Xác suất tìm thấy electron ở AO s (hình a) là khoảng 90%. Đúng||Sai
Orbital nguyên tử có một số hình dạng khác nhau như AO hình cầu, còn gọi là AOs, AO hình số tám nổi, còn gọi là AO p.

Hình dạng AO s (hình a) và AO p (hình b, c, d)
a. Các AO p trong cùng một lớp electron có kích thước và hình dạng tương tự nhau nhưng khác nhau về định hướng trong không gian. Đúng||Sai
b. Chỉ có các AO s và p, không có các AO như d và f. Sai||Đúng
c. Xác suất tìm thấy electron ở mỗi thuỳ trong hình b là khoảng 90%. Sai||Đúng
d. Xác suất tìm thấy electron ở AO s (hình a) là khoảng 90%. Đúng||Sai
a. Các AO p trong cùng một lớp electron có kích thước và hình dạng tương tự nhau nhưng khác nhau về định hướng trong không gian. Đúng
b. Chỉ có các AO s và p, không có các AO như d và f Sai vì ngoài các AO s và p còn có các AO d và f có hình dạng phức tạp hơn
c. Xác suất tìm thấy electron ở mỗi thuỳ trong hình b là khoảng 90% Sai vì Xác suất tìm thấy electron trong AO p là khoảng 90% nên xác suất tìm thấy electron ở mỗi thùy là khoảng 45%.
d. Xác suất tìm thấy electron ở AO s (hình a) là khoảng 90%. Đúng
Ba nguyên tử X, Y, Z có số proton và số neutron như sau: X: 20 proton và 20 neutron. Y: 18 proton và 22 neutron. Z: 20 proton và 22 neutron. Có bao nhiêu nguyên tử trong các nguyên tử trên thuộc cùng một nguyên tố?
Ba nguyên tử X, Y, Z có số proton và số neutron như sau: X: 20 proton và 20 neutron. Y: 18 proton và 22 neutron. Z: 20 proton và 22 neutron. Có bao nhiêu nguyên tử trong các nguyên tử trên thuộc cùng một nguyên tố?
Tất cả các nguyên tử thuộc về một nguyên tố hóa học đều có cùng số hiệu nguyên tử (số proton), do đó có cùng số electron.
Vậy 2 nguyên tử X và Z thuộc cùng 1 nguyên tố hoá học
Cho 5 nguyên tố có số hiệu lần lượt là 7, 11, 16, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố kim loại?
Cho 5 nguyên tố có số hiệu lần lượt là 7, 11, 16, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố kim loại?
Cấu hình electron của nguyên tố có số hiệu lần lượt là 7, 11, 16, 19 và 20
1s22s22p3 Có 5 electron lớp ngoài cùng
phi kim
1s22s22p63s1 Có 1 electron lớp ngoài cùng
kim loại
1s22s22p63s23p4 Có 6 electron lớp ngoài cùng
phi kim
1s22s22p63s23p64s1 Có 1 electron lớp ngoài cùng
kim loại
1s22s22p63s23p64s2 Có 2 electron lớp ngoài cùng
kim loại
Vậy trong số các nguyên tố trên có 3 nguyên tố kim loại
Nguyên tử X có Z = 26. Khi nguyên tử X cho đi 3 electron thì phân lớp ngoài cùng của ion sẽ có số electron là bao nhiêu?
Nguyên tử X có Z = 26. Khi nguyên tử X cho đi 3 electron thì phân lớp ngoài cùng của ion sẽ có số electron là bao nhiêu?
Cấu hình electron của X là: [Ar]3d64s2
Khi mất 3 electron, nguyên tử sẽ mất electron lần lượt từ phân lớp ngoài vào trong.
Cấu hình electron của X3+ là: [Ar]3d5.
Vậy khi nguyên tử X cho đi 3 electron thì phân lớp ngoài cùng của ion sẽ có số electron là 7 electron
Nguyên tố chlorine (kí hiệu: Cl) có hai đồng vị bền với tỉ lệ phần trăm số nguyên tử tương ứng là: chiếm 75,77% và
chiếm 24,23%. Trong phân tử CaCl2, % khối lượng của
là bao nhiêu? (Biết nguyên tử khối trung bình của Calcium là 40)
Nguyên tố chlorine (kí hiệu: Cl) có hai đồng vị bền với tỉ lệ phần trăm số nguyên tử tương ứng là: chiếm 75,77% và
chiếm 24,23%. Trong phân tử CaCl2, % khối lượng của
là bao nhiêu? (Biết nguyên tử khối trung bình của Calcium là 40)
Nguyên tử khối trung bình của chlorine là:
Ta có:
Phân tử khối của CaCl2 là: 40 + 35,4846.2 = 110,9692
Vậy (CaCl2)
Ở trạng thái cơ bản nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là bao nhiêu?
Ở trạng thái cơ bản nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là bao nhiêu?
Nguyên tử nguyên tố X có 4 electron ở lớp L
X có 2 electron ở phân lớp 2s và 2 electron ở phân lớp 2p
Cấu hình electron của X là 1s22s22p2
Z= 6
Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10. Tìm số khối của nguyên tử nguyên tố X?
Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10. Tìm số khối của nguyên tử nguyên tố X?
Trong X: số proton = số electron = số hiệu nguyên tử (Z)
Đặt số neutron trong X là N.
Với các nguyên tử bền ta có:
Theo bài ra có:
Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10 nên:
2Z + N = 10 ⇒ N = 10 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 10 – 2Z ≤ 1,52Z
⇔ 2,84 ≤ Z ≤ 3,33
Vậy Z = 3 thỏa mãn ⇒ N = 4.
Số khối của X bằng Z + N = 7.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
