Liên kết trong phân tử có độ phân cực lớn nhất
Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
Từ F đến I, độ âm điện giảm dần
=> Độ phân cực H-X giảm dần
=> H-F có độ phân cực lớn nhất (do có độ âm điện lớn nhất)
NB
1
Cùng nhau làm bài kiểm tra khảo sát chất lượng môn Hóa 10 sách Kết nối tri thức nha!
Liên kết trong phân tử có độ phân cực lớn nhất
Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
Từ F đến I, độ âm điện giảm dần
=> Độ phân cực H-X giảm dần
=> H-F có độ phân cực lớn nhất (do có độ âm điện lớn nhất)
NB
1
Phản ứng thu nhiệt
Phản ứng nào sau đây là phản ứng thu nhiệt?
Các phản ứng: tôi vôi, đốt than củi, đốt nhiên liệu đều giải phóng năng lượng dưới dạng nhiệt ra môi trường ⇒ Là phản ứng tỏa nhiệt.
Phản ứng phân hủy đá vôi cần cung cấp nhiệt để phản ứng xảy ra, ngừng cung cấp nhiệt phản ứng sẽ dừng lại ⇒ Là phản ứng thu nhiệt.
Xác định tỉ lệ phản ứng
Sunlfur tác dụng với acid sunlfuric đặc, nóng:
S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử sunlfur bị khử : số nguyên tử sunlfur bị oxi hóa là:
Phản ứng
S + 2H2SO4 → 3SO2 + 2H2O
S là chất khử, H2SO4 là chất oxi hóa
Tỉ lệ số nguyên tử sunlfur bị khử : số nguyên tử sunlfur bị oxi hóa là: 2 : 1
Quá trình nung vôi
Trong quá trình nung vôi người ta phải xếp đá vôi lẫn với than trong lò vì
Khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò. Vì phản ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than, nếu dừng cung cấp nhiệt thì phản ứng nung vôi sẽ không tiếp diễn.
Hiện tượng phản ứng
Nhỏ vài giọt dung dịch silver nitrate (AgNO3) vào ống nghiệm chứa dung dịch sodiumbromine (NaBr), ta thấy
Phản ứng
AgNO3 + NaBr → AgBr + NaNO3,
Hiện tượng: xuất hiện kết tủa màu vàng nhạt
Xác định số oxi hóa
Trong hợp chất Na2SO3, số oxi hóa của sulfur (lưu huỳnh) là
Gọi số oxi hóa của S là x
Ta có 1.2 + 2.x + 7.(-2) = 0 ⇒ x = 6 ⇒ số oxi hóa của S là +6
Yếu tố ảnh hưởng đến tốc độ phản ứng
Cho phản ứng: 2H2O2 (l) 2H2O (l) + O2(g). Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên?
Các yếu tố ảnh hưởng đến tốc độ của phản ứng trên :
Nồng độ H2O2 : nếu tăng nồng độ H2O2 thì tốc độ phản ứng tăng.
Thêm chất xúc tác : làm tăng tốc độ của phản ứng.
Nhiệt độ : nếu tăng nhiệt độ thì tốc độ phản ứng tăng.
Yếu tố không ảnh hưởng đến tốc độ của phản ứng là áp suất vì chất tham gia không phải là chất khí.
Vai trò của Cl2 trong phản ứng
Trong phản ứng: 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Thì Cl2 đóng vai trò
Xác định số oxi hóa
3Cl02 + 6KOH → KCl+5O3 + 5KCl-1 + 3H2O
Chlorine có số oxi hóa tăng từ 0 lên +5 và giảm từ 0 xuống -1 sau phản ứng nên Cl2 vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử
Tính oxi hóa của các halogen
Tính oxi hóa của các halogen biến đổi theo dãy nào sau đây?
Tính oxi hóa là khả năng nhận electron của nguyên tử
Vì bán kính nguyên tử tăng dần: F < Cl < Br < I ⇒ Bán kính càng lớn ⇒ càng dễ bị mất electron
Độ âm điện giảm dần: F > Cl > Br > I ⇒ Vì F2 có độ âm điện lớn nhất nên lực hút giữa hạt nhân với electron lớp ngoài cùng là lớn nhất.
Phản ứng chứng minh tính khử ion halide
Phản ứng nào sau đây chứng minh tính khử của ion halide?
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
⇒ Không có sự thay đổi số oxi hóa
Br từ -1 lên 0
⇒ Thể hiện tính khử
CaO + 2HCl → CaCl2 + H2O.
⇒ Không có sự thay đổi số oxi hóa
HI + NaOH → NaI + H2O.
⇒ Không có sự thay đổi số oxi hóa.
Để cắt sắt
Để cắt sắt, thép người ta thường dùng đèn xì oxygen-acetylene. Khi đốt cháy acetylene, nhiệt lượng giải phóng lớn nhất khi acetylene cháy trong
Để cắt sắt, thép người ta thường dùng đèn xì oxygen-acetylene. Khi đốt cháy acetylene, nhiệt lượng giải phóng lớn nhất khi acetylene cháy trong khí oxygen nguyên chất
Khử trùng nước sinh hoạt
Halogen nào sau đây được dùng để khử trùng nước sinh hoạt?
Halogen được dùng để khử trùng nước sinh hoạt là Cl2.
Khắc chữ lên thủy tinh
Acid nào được dùng để khắc lên thủy tinh?
Dung dịch HF có khả năng ăn mòn SiO2 (thành phần chính của thủy tinh) nên được dùng để khắc chữ lên thủy tinh.
Phương trình hóa học
4HF + SiO2 → SiF4 + 2H2O
Tốc độ phản ứng sẽ lớn nhất khi dùng
Khi cho cùng một lượng aluminium (Al) vào cốc đựng dung dịch acid HCl 0,1M (dư), tốc độ phản ứng sẽ lớn nhất khi dùng
Diện tích tiếp xúc càng lớn thì phản ứng càng dễ xảy ra → khi Al dạng bột là có diện tích tiếp xúc lớn nhất nên tốc độ phản ứng lớn nhất
Nhiệt độ càng cao thì tốc độ phản ứng nhanh hơn Al dạng bột mịn ở 35oC
Sulfur chỉ thể hiện tính khử
Nguyên tử sulfur chỉ thể hiện tính khử trong hợp chất nào sau đây?
Nguyên tử sulfur chỉ thể hiện tính khử trong hợp chất H2S vì hợp chất H2S có số oxi hóa thấp nhất của S là -2.
Trong các phản ứng oxi hóa khử, số oxi hóa -2 chỉ có thể tăng, không thể giảm.
Biến thiên enthalpy chuẩn
Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình:
|
Chất |
N2O4 (g) |
NO2 (g) |
|
Nhiệt tạo thành chuẩn (kJ/mol) |
9,16 |
33,20 |
Biến thiên enthalpy chuẩn của phản ứng sau: 2NO2(g) → N2O4(g) là
Phản ứng sau:
2NO2(g) → N2O4(g)
Biến thiên enthalpy chuẩn của phản ứng là:
= 9,16 – 2. 33,20 = – 57,24 (kJ)
Tốc độ của phản ứng
Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 15°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 40°C.
Tốc độ của phản ứng ở 40 °C là:
Tốc độ trung bình của phản ứng
Cho phản ứng phân hủy N2O5:
2N2O5(g) → 4NO2(g) + O2(g).
Tốc độ trung bình của phản ứng trên được biểu diễn bằng biểu thức nào trong những biểu thức sau?
Biểu thức tốc độ trung bình của phản ứng: 2N2O5(g) → 4NO2(g) + O2(g).
là
.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Tốc độ của phản ứng hoá học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng được sử dụng hoặc sản phẩm được tạo thành.
a) Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ. Sai||Đúng
b) Tốc độ của phản ứng hoá học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian. Đúng||Sai
c) Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương. Sai||Đúng
d) Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M. Đúng||Sai
Tốc độ của phản ứng hoá học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng được sử dụng hoặc sản phẩm được tạo thành.
a) Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ. Sai||Đúng
b) Tốc độ của phản ứng hoá học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian. Đúng||Sai
c) Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương. Sai||Đúng
d) Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M. Đúng||Sai
a) Sai:
Vì trong cùng một phản ứng hoá học, tốc độ tiêu thụ của các chất phản ứng khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
b) Đúng
c) Sai:
Vì tốc độ phản ứng có giá trị dương.
d) Đúng.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen, gồm 4 nguyên tố hay gặp: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide.
a) Các đơn chất nhóm VIIA vừa thể hiện tính oxi hoá, vừa thể hiện tính khử; mức độ phản ứng giảm dần từ fluorine đến iodine. Sai||Đúng
b) Tương tác van der Waals của các đơn chất halogen tăng từ fluorine đến iodine đã góp phần làm tăng nhiệt độ sôi của chúng. Đúng||Sai
c) Halogen được điều chế bằng cách điện phân có màn ngăn dung dịch muối ăn là bromine. Sai||Đúng
d) Trong cơ thể người, nguyên tố iodine tập trung ở tuyến giáp trạng. Đúng||Sai
Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen, gồm 4 nguyên tố hay gặp: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide.
a) Các đơn chất nhóm VIIA vừa thể hiện tính oxi hoá, vừa thể hiện tính khử; mức độ phản ứng giảm dần từ fluorine đến iodine. Sai||Đúng
b) Tương tác van der Waals của các đơn chất halogen tăng từ fluorine đến iodine đã góp phần làm tăng nhiệt độ sôi của chúng. Đúng||Sai
c) Halogen được điều chế bằng cách điện phân có màn ngăn dung dịch muối ăn là bromine. Sai||Đúng
d) Trong cơ thể người, nguyên tố iodine tập trung ở tuyến giáp trạng. Đúng||Sai
a) Sai vì
vì fluorine chỉ thể hiện tính oxi hóa.
b) Đúng
c) Sai vì
Halogen được điều chế bằng cách điện phân có màn ngăn dung dịch muối ăn là chlorine
d) Đúng
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Cho các phát biểu sau:
a) Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử. Sai||Đúng
b) Năng lượng liên kết tăng dần từ HF đến HI. Sai||Đúng
c) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử. Đúng||Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X. Sai||Đúng
Cho các phát biểu sau:
a) Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử. Sai||Đúng
b) Năng lượng liên kết tăng dần từ HF đến HI. Sai||Đúng
c) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử. Đúng||Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X. Sai||Đúng
a) Sai vì
vì với sulfuric acid đặc, ion Cl- không thể hiện tính khử.
b) Sai vì
Năng lượng liên kết giảm dần từ HF đến HI.
c) Đúng
d) Sai vì
sai vì ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai
Trong phòng thí nghiệm, khí chlorine được điều chế, làm khô và thu vào bình theo sơ đồ dưới đây.
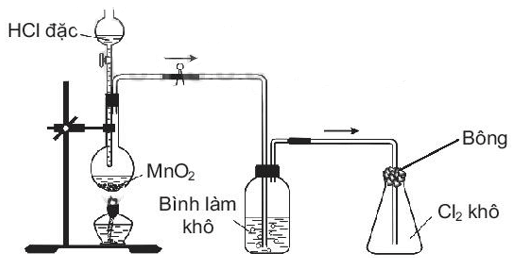
a) Khí chlorine thu được có thể lẫn hơi nước để làm khô khí chlorine ta sử dụng dung dịch nước vôi trong. Sai||Đúng
b) Để hạn chế khí Cl2bay ra cần chọn dung dịch NaOH 4% để tẩm vào bông đậy ở miệng bình thu khí. Đúng||Sai
c) Nhúng giấy quỳ vào dung dịch nước chlorine thì thấy giấy quỳ chuyển sang màu đỏ, ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất do Cl2 có tính oxi hóa mạnh. Sai||Đúng
d) Phản ứng điều chế khí chlorine MnO2 đóng vai trò là chất xúc tác. Sai||Đúng
Trong phòng thí nghiệm, khí chlorine được điều chế, làm khô và thu vào bình theo sơ đồ dưới đây.

a) Khí chlorine thu được có thể lẫn hơi nước để làm khô khí chlorine ta sử dụng dung dịch nước vôi trong. Sai||Đúng
b) Để hạn chế khí Cl2bay ra cần chọn dung dịch NaOH 4% để tẩm vào bông đậy ở miệng bình thu khí. Đúng||Sai
c) Nhúng giấy quỳ vào dung dịch nước chlorine thì thấy giấy quỳ chuyển sang màu đỏ, ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất do Cl2 có tính oxi hóa mạnh. Sai||Đúng
d) Phản ứng điều chế khí chlorine MnO2 đóng vai trò là chất xúc tác. Sai||Đúng
a) Sai vì
Dung dịch hút ẩm cần có khả năng hút nước và không tác dụng với chất cần làm khô là Cl2, do vậy không chọn dung dịch có tính kiềm. Ví dụ chọn dung dịch H2SO4 đặc.
b) Đúng.
c) Sai vì
Dung dịch nước chlorine gồm nước; hydrochloric acid (HCl); hypochlorous acid (HClO) và chlorine.
Nhúng giấy quỳ vào dung dịch nước chlorine thì thấy giấy quỳ chuyển sang màu đỏ do trong dung dịch nước chlorine có chứa các acid.
Nhưng ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất vì HClO có tính oxi hóa mạnh có thể phá hủy các hợp chất màu.
d) Sai vì
4HCl + MnO2 Cl2 + MnCl2 + 2H2O
Chất khử: HCl (số oxi hóa của Cl tăng từ -1 lên 0)
Chất oxi hóa: MnO2 (số oxi hóa của Mn giảm từ +4 xuống +2)
Điền vào chỗ trống câu trả lời ngắn
Cho một số phương trình nhiệt hóa học sau?
(1) CaCO3(s) → CaO(s) + CO2(g) ![]()
(2) C2H4(g) + H2(g) → C2H6(g) ![]()
(3) CuSO4 (aq) + Zn (s) → ZnSO4 (aq) + Cu (s) ![]()
(4) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) ![]()
Số quá trình thu nhiệt là bao nhiêu?
Cho một số phương trình nhiệt hóa học sau?
(1) CaCO3(s) → CaO(s) + CO2(g) ![]()
(2) C2H4(g) + H2(g) → C2H6(g) ![]()
(3) CuSO4 (aq) + Zn (s) → ZnSO4 (aq) + Cu (s) ![]()
(4) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) ![]()
Số quá trình thu nhiệt là bao nhiêu?
Phản ứng (2); (3); (4) có là phản ứng tỏa nhiệt
Phản ứng (1) cóphản ứng thu nhiệt
Vậy có 1 quá trình thu nhiệt
Điền vào chỗ trống câu trả lời ngắn
Cho các chất sau: CaOCl2, Zn, KMnO4, NaOH, CaCO3. Số chất tác dụng được với HCl, HCl thể hiện tính khử là bao nhiêu?
Cho các chất sau: CaOCl2, Zn, KMnO4, NaOH, CaCO3. Số chất tác dụng được với HCl, HCl thể hiện tính khử là bao nhiêu?
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
(Cl tăng từ -1 lên 0)
Vậy HCl đóng vai trò chất khử
Zn + 2HCl → ZnCl2 + H2
(H từ +1 xuống 0) ⇒ HCl là chất oxi hóa
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
(H từ -1 lên -0) ⇒ HCl đóng vai trò chất khử
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Không có sự thay đổi số oxi hóa
NaOH + HCl → NaCl + H2O
Không có sự thay đổi số oxi hóa
Vậy có 2 chất thỏa mãn
Điền vào chỗ trống câu trả lời ngắn
Người ta thường tách bromine trong rong biển bằng quá trình sục khí chlorine vào dung dịch chiết chứa ion bromide. Phương trình hóa học của phản ứng có thể được mô tả dạng thu gọn như sau:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Cho các số liệu enthalpy tạo thành chuẩn (kJ/mol−1) trong bảng dưới đây:
|
Br-(aq) |
Cl-(aq) |
Br2(aq) |
Cl2(aq) |
|
-121,55 |
-167,16 |
-2,16 |
-17,30 |
Tính biến thiên enthalpy chuẩn phản ứng trên.
Người ta thường tách bromine trong rong biển bằng quá trình sục khí chlorine vào dung dịch chiết chứa ion bromide. Phương trình hóa học của phản ứng có thể được mô tả dạng thu gọn như sau:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Cho các số liệu enthalpy tạo thành chuẩn (kJ/mol−1) trong bảng dưới đây:
|
Br-(aq) |
Cl-(aq) |
Br2(aq) |
Cl2(aq) |
|
-121,55 |
-167,16 |
-2,16 |
-17,30 |
Tính biến thiên enthalpy chuẩn phản ứng trên.
Với phản ứng:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Dựa vào enthalpy tạo thành chuẩn của các chất, biến thiên enthalpy chuẩn của phản ứng được tính như sau:
= 2 × (-167,16) + (-2,16) – 2 × (-121,55) – (-17,3) = -76,08 (kJ).
Điền vào chỗ trống câu trả lời ngắn
Cho kim loại Zinc (Zn) vào 400 ml dung dịch HBr 0,2M, sau 60 giây đầu tiên thu được 0,7437 lít khí H2 (đkc). Tính tốc độ trung bình của phản ứng tính theo HBr trong khoảng thời gian trên.
Cho kim loại Zinc (Zn) vào 400 ml dung dịch HBr 0,2M, sau 60 giây đầu tiên thu được 0,7437 lít khí H2 (đkc). Tính tốc độ trung bình của phản ứng tính theo HBr trong khoảng thời gian trên.
Phản ứng:
Zn (s) + 2HBr (aq) → ZnBr2 (aq) + H2 (g)
nH2 = 0,7437 : 24,79 = 0,03 mol
Theo phương trình phản ứng:
nHBr phản ứng = 2.nH2 = 0,03.2 = 0,06 mol
Điền vào chỗ trống câu trả lời ngắn
Hỗn hợp X gồm CuO và Fe2O3, Hòa tan hoàn toàn 44 gam X bằng dung dịch HCl dư, sau phản ứng thu được dung dịch chứa 85,25 gam muối. Mặt khác, nếu khử hoàn toàn 22 gam X bằng CO dư, cho hỗn hợp khí thu được sau phản ứng lội từ từ qua dung dịch Ba(OH)2 (dư) thì thu được m gam kết tủa. Giá trị của m là:
Hỗn hợp X gồm CuO và Fe2O3, Hòa tan hoàn toàn 44 gam X bằng dung dịch HCl dư, sau phản ứng thu được dung dịch chứa 85,25 gam muối. Mặt khác, nếu khử hoàn toàn 22 gam X bằng CO dư, cho hỗn hợp khí thu được sau phản ứng lội từ từ qua dung dịch Ba(OH)2 (dư) thì thu được m gam kết tủa. Giá trị của m là:
Gọi x, y lần lượt là số mol của CuO và Fe2O3
Trong 22 gam hỗn hợp X ta có:
80x + 160y = 22 (gam) (1)
Hòa tan hoàn toàn 44 gam X bằng dung dịch HCl dư thu 85,25 gam muối
Hòa tan hoàn toàn 22 gam X thu được 85,25:2= 42,625 gam
CuO + 2HCl → CuCl2 + H2O
x → x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
y → 2y (mol)
mmuối = mCuCl2 + mFeCl3
= 135z + 162,5.2y = 42,625 gam (2)
Giải hệ phương trình (1) và (2) ta được: x = 0,075 mol; y = 0,1 mol
CuO + CO Cu + CO2
Fe2O3 + 3CO 2Fe + 3CO2
Ta có: nCO2= nCuO+ 3.nFe2O3= x + 3y = 0,375 mol
CO2 + Ba(OH)2 → BaCO3+ H2O
→nBaCO3= nCO2= 0,375 mol
→mBaCO3= 0,375.197 = 73,875 gam
Điền vào chỗ trống câu trả lời ngắn
Khi nhiệt độ tăng thêm 100C tốc độ phản ứng hóa học tăng thêm 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 300C) tăng lên 81 lần thì cần thực hiện ở nhiệt độ nào?
Khi nhiệt độ tăng thêm 100C tốc độ phản ứng hóa học tăng thêm 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 300C) tăng lên 81 lần thì cần thực hiện ở nhiệt độ nào?
Gọi nhiệt độ của phản ứng trước và sau khi tăng là t1, t2.
Tốc độ phản ứng tăng lên 3 lần nên:
= 3 (1)
Theo đề bài ta có, nhiệt độ tăng thêm 10oC nên t2 – t1 = 10oC
Thay vào (1) ta có:
Khi tốc độ phản ứng tăng lên 81 lần và t1 = 30oC
=
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
