Mức độ liên kết hydrogen của hợp chất
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào trạng thái vật chất của hợp chất.
Cùng nhau thử sức với bài kiểm tra 15 phút Hóa 10 Chương 3 Liên kết hóa học.
Mức độ liên kết hydrogen của hợp chất
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào trạng thái vật chất của hợp chất.
Công thức cấu tạo của SO2 theo quy tắc octet
Theo quy tắc octet thì công thức cấu tạo của phân tử SO2 là
Theo qui tắc octet thì công thức cấu tạo của phân tử SO2 là O = S → O.
Vì S và O mỗi nguyên tố đưa ra một cặp electron để góp chung, như vậy S còn 2 cặp electron nữa sẽ đưa ra một cặp electron cho O.
Tính số chất mà phân tử chỉ chứa liên kết đơn
Cho dãy các chất: N2, H2, NH3, CO2, HCl, H2O, C2H4. Số chất mà phân tử chỉ chứa liên kết đơn là:
Công thức cấu tạo của các chất:
N2: NN H2: H
H
NH3: ![]() CO2: C=C=O
CO2: C=C=O
HCl: HCl H2O: H
O
H
C2H4: 
Các chất chỉ chứa liên kết đơn là: H2, NH3, HCl, H2O
Phương trình biểu diễn sự hình thành ion không đúng
Phương trình biểu diễn sự hình thành ion nào sau đây không đúng?
Phương trình biểu diễn sự hình thành ion đúng:
Al + 3e → Al3+
Dãy chất có cùng cấu hình
Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
X nhường 1e tạo thành ion X+ có cấu hình 1s22s22p6
⇒ cấu hình e của X là 1s22s22p63s1 ⇒ ZX = 11 (Na)
Y nhận 1e tạo thành ion Y- có cấu hình 1s22s22p6
⇒ cấu hình e của Y là 1s22s22p5 ⇒ ZY = 9 (F)
Z có cấu hình 1s22s22p6 ⇒ ZZ = 10 (Ne)
Tính số ion có 10 electron
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10 electron là:
Na có Z = 11 số e = 11
ion Na+ có số e = 11 – 1 = 10
Mg có Z = 12 số e = 12
ion Mg2+ có số e = 12 – 2 = 10
Al có Z = 13 số e = 13
ion Al3+ có số e = 13 – 3 = 10
Ca có Z = 20 số e = 20
ion Ca2+ có số e = 20 – 2 = 18
S có Z = 16 số e = 16
ion S2- có số e = 16 + 2 = 18
Cl có Z = 17 số e = 17
ion Cl- có số e = 17 + 1 = 18
O có Z = 8 số e = 8
ion O2- có số e = 8 + 2 = 10
Vậy có 4 ion có 10 electron.
Lực liên kết
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Xác định nguyên tử
Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
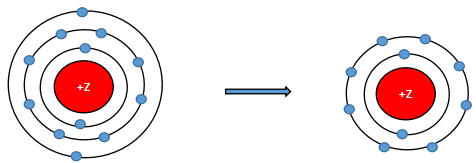
Theo mô hình mô tả ta thấy nguyên tử này có 12 electron và nhường đi 2 electron để đạt lớp vỏ thỏa mãn quy tắc octet.
Vậy nguyên tử này là Magnesium.
Liên kết có lực liên kết yếu
Những liên kết có lực liên kết yếu như
Các nguyên tử trong phân tử liên kết với nhau bằng những liên kết có lực liên kết mạnh như liên kết ion, liên kết cộng hóa trị.
Các phân tử cũng có thể liên kết với nhau bằng những liên kết có lực yếu hơn như liên kết hydrogen, tương tác van der Waals.
Xác định liên kết hóa học
Liên kết hóa học trong phân tử KCl là:
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu, thường được hình thành giữa kim loại điển hình và phi kim điển hình.
⇒ Liên kết hóa học trong phân tử KCl là liên kết ion.
Phân tử không được hình thành từ liên kết cộng hóa trị
Phân tử nào sau đây không được hình thành từ liên kết cộng hóa trị?
K và O là kim loại điển hình và phi kim điển hình liên kết được hình thành là liên kết ion.
Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
Lưỡng cực tạm thời xuất hiện là do sự chuyển động của các electron di chuyển tập trung về một phía bất kì của phân tử.
Công thức và liên kết hợp chất tạo thành từ X và Y
X, Y là những nguyên tố có đơn vị điện tích hạt nhân lần lượt là 11, 16. Công thức và liên kết hợp chất tạo thành từ X và Y là
Cấu hình electron nguyên tử X (Z = 11): 1s22s22p63s1
→ X là kim loại nhóm IA.
→ X có xu hướng nhường 1 electron khi hình thành liên kết hóa học:
X → X+ + 1e
Cấu hình electron nguyên tử Y (Z = 16): 1s22s22p63s23p4
→ Y là phi kim nhóm VIA.
→ Y có xu hướng nhận 2 electron khi hình thành liên kết hóa học:
Y + 2e → Y2-
Vậy hợp chất tạo thành là X2Y, liên kết trong hợp chất là liên kết ion.
Nguyên tử nguyên tố nào có xu hướng nhận 2e
Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
Sulfur (Z = 16) có cấu hình electron: 1s22s22p63s23p4 ⇒ là phi kim với 6 electron lớp ngoài cùng ⇒ có xu hướng nhận 2 electron để đạt được cấu hình electron bền vững.
Neon (Z = 10) có cấu hình electron: 1s22s22p6⇒ là khí hiếm với 8 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Carbon (Z = 6) có cấu hình electron: 1s22s22p2⇒ là phi kim với 4 electron lớp ngoài cùng ⇒ có xu hướng nhận 4 electron để đạt được cấu hình electron bền vững.
Magnesium (Z = 12) có cấu hình electron: 1s22s22p63s2 ⇒ là kim loại với 2 electron lớp ngoài cùng ⇒ có xu hướng nhường 2 electron để đạt được cấu hình electron bền vững.
Phân tử chất chỉ có các liên kết cộng hóa trị phân cực
Phân tử chất nào sau đây chỉ có các liên kết cộng hóa trị phân cực?
Ta có:
0,4 < = 3,44 - 2,55 = 0,89 < 1,7
H2O là hợp chất cộng hóa trị phân cực.
Liên kết hydrogen càng bền chặt khi
Cho kí hiệu tổng quát của một liên kết hydrogen:
![]()
Trong đó: X, Y là các nguyên tử N, O, F
Liên kết hydrogen càng bền chặt khi
Liên kết hydrogen càng bền chặt khi phần điện tích dương trên H càng dương (X có độ âm điện càng lớn tức hút electron về phía X càng mạnh) và phần điện tích âm trên Y càng âm (Y có độ âm điện lớn).
Số lượng e tham gia hình thành liên kết
Số lượng electron tham gia hình thành liên kết đơn, đôi và ba lần lượt là:
Mỗi liên kết được hình thành do sự dùng chung 1 cặp (2 electron).
Liên kết đơn được hình thành từ 2 electron.
Liên kết đôi được hình thành từ 4 electron.
Liên kết ba được hình thành từ 6 electron.
X có điện tích hạt nhân là +11 khi hình thành liên kết hóa học X có xu hướng
Nguyên tử X có điện tích hạt nhân là +11. Khi hình thành liên kết hóa học X có xu hướng?
Nguyên tử X có điện tích hạt nhân là +11 → ZX =11
→ Cấu hình electron: 1s22s22p63s1 → có 1 electron lớp ngoài cùng → xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất.
Cấu hình electron của ion Mg2+
Nguyên tử Mg có Z = 12. Cấu hình electron của ion Mg2+ là
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2.
Nguyên tử Mg nhường 2 electron để tạo thành ion Mg2+: Mg Mg2+ + 2e.
Cấu hình electron của ion Mg2+ là 1s22s22p6 (giống khí hiếm Neon).
Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực
X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là
Cấu hình electron nguyên tử X là: [He]2s22p4 X là phi kim, thuộc nhóm VIA
Cấu hình electron nguyên tử Y là: [Ar]4s1 Y là kim loại, thuộc nhóm IA.
Cấu hình electron nguyên tử Z là: [Ne]3s23p4 Z là phi kim, thuộc nhóm VIA.
Liên kết hình thành giữa X và Y; Y và Z là liên kết ion.
Liên kết hình thành giữa X và Z là liên kết cộng hóa trị có cực.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
