Orbital có dạng số tám nổi
Orbital nào sau đây có dạng số tám nổi?
Orbital p có dạng số tám nổi.
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 10 tháng 11, cùng nhau luyện tập và xem kết quả nha!
Orbital có dạng số tám nổi
Orbital nào sau đây có dạng số tám nổi?
Orbital p có dạng số tám nổi.
Xác định cặp chất đồng vị
Trong những hợp chất sau đây, cặp chất nào là đồng vị của nhau?
Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau.
⇒ Cặp chất là đồng vị là và
.
Tính số electron độc thân
Nếu 7 electron được điền vào 5 AO thì số lượng electron độc thân là
Mỗi AO chứa tối đa 2 electron, như vậy nếu 7 electron được điền vào 5 AO thì sẽ có 2 AO đã chứa đủ electron tối đa, 3 AO chỉ chứa 1 electron (electron độc thân).
Hạt có khối lượng rất nhỏ so với các loại hạt còn lại
Trong nguyên tử, hạt nào có khối lượng rất nhỏ so với các loại hạt còn lại?
Electron có khối lượng rất nhỏ so với các loại hạt còn lại.
Tìm phát biểu đúng
Phát biểu nào sau đây đúng?
- Những electron ở gần hạt nhân có mức năng lượng thấp nhất.
- Electron ở orbital 3p có mức năng lượng cao hơn electron ở orbital 3s.
- Các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
Phân lớp có 3 orbital
Phân lớp nào sau đây có 3 orbital nguyên tử (3 AO)?
Phân lớp ns chỉ có 1 AO.
Phân lớp np có 3 AO.
Phân lớp nd có 5 AO.
Phân lớp nf có 7 AO.
Xác định số loại phân tử oxygen được tạo thành
Số loại phân tử oxygen (O2) có thể được tạo thành từ hai đồng vị 16O, 17O là
Các phân tử O2 tương ứng là: 16O16O, 16O17O, 17O17O.
⇒ Số loại phân tử oxygen (O2) có thể được tạo thành từ hai đồng vị 16O, 17O là 3.
Số proton và số neutron có trong một nguyên tử aluminium
Số proton và số neutron có trong một nguyên tử aluminium () lần lượt là:
Số proton của nguyên tử aluminium là: P = 13.
Số neutron của nguyên tử aluminium là: N = A – P = 27 – 13 = 14.
Xác định số chu kì nhỏ và chu kì lớn
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là:
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là: 3 và 4.
Xác định loại nguyên tố
Nguyên tố X có Z = 11 thuộc loại nguyên tố nào sau đây?
Nguyên tử có Z = 11 ⇒ Cấu hình e: 1s22s22p63s1.
⇒ Electron cuối cùng xếp vào phân lớp s nên thuộc nguyên tố s.
Bán kính của nguyên tử các nguyên tố trong cùng một chu kì
Trong một chu kì, bán kính nguyên tử các nguyên tố
Trong một chu kì, bán kính nguyên tử các nguyên tố giảm theo chiều tăng dần của điện tích hạt nhân.
Xác định các nguyên tố kim loại
Cho các nguyên tố X, Y, Z, T có cấu hình electron nguyên tử là:
X: 1s22s22p63s23p4
Y: 1s22s22p63s23p6
Z: 1s22s22p63s23p64s2
T: 1s22s22p63s1
Trong các nguyên tố X, Y, Z, T nguyên tố kim loại là
Từ cấu hình electron, có thể dự đoán tính chất theo quy tắc:
- Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là nguyên tử nguyên tố kim loại.
- Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim.
- Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He có 2 electron) là các nguyên tử nguyên tố khí hiếm.
Xác định nguyên tử khối trung bình của mẫu Li
Phổ khối lượng của một mẫu lithium cho thấy nó chứa hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là
Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là:
Xác định thứ tự tính kim loại giảm dần của các nguyên tố
Cho các nguyên tố Na, Mg, K. Thứ tự tính kim loại giảm dần của các nguyên tố đó là
Na và K thuộc cùng nhóm IA. Na thuộc chu kì 3, K thuộc chu kì 4 ⇒ tính kim loại K > Na.
Na và Mg thuộc cùng chu kì 2, Na thuộc IA, Mg thuộc IIA ⇒ tính kim loại Na > Mg.
Do vậy tính kim loại giảm theo thứ tự: K > Na > Mg.
Cặp nguyên tố có khả năng tạo thành liên kết ion
Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
Liên kết ion được tạo thành giữa kim loại điển hình và phi kim điển hình.
Vậy liên kết giữa calcium và oxygen là liên kết ion.
Cấu hình electron ứng với nguyên tố có độ âm điện lớn nhất
Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
Ta có 1s22s22p5 là cấu hình electron của F (Z = 9), đây là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn (3,98).
Nguyên tử lithium có xu hướng nhường hay nhận electron
Nguyên tử lithium (Z = 3) có xu hướng nhường hay nhận bao nhiêu electron để lớp vỏ thoả mãn quy tắc octet?
Lithium (Z = 3) có cấu hình electron: 1s22s1.
Li có 1 electron ở lớp ngoài cùng, có xu hướng nhường đi 1 electron để đạt cấu hình của khí hiếm He.
Oxide nào sau đây tạo ra môi trường acid khi cho vào nước
Oxide nào sau đây tạo ra môi trường acid khi cho vào nước?
SO3 là ocidic oxide nên tạo ra môi trường acid khi cho vào nước.
Các electron có khả năng tham gia hình thành liên kết cộng hoá trị
Trong nguyên tử C, những electron có khả năng tham gia hình thành liên kết cộng hoá trị thuộc phân lớp nào sau đây?
Cấu hình electron của carbon (C): 1s22s22p2.
Trong nguyên tử C, electron có khả năng tham gia hình thành liên kết cộng hóa trị là các electron ở lớp ngoài cùng hay là các electron ở phân lớp 2s; 2p.
Liên kết trong phân tử được hình thành nhờ sự xen phủ orbital s – p
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – p?

Sơ đồ thể hiện sự xen phủ s - p
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
⇒ Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Ở mỗi phát biểu, chọn đúng hoặc sai
Mỗi phát biểu sau đây về mô hình nguyên tử hiện đại là đúng hay sai?
(1) Theo mô hình nguyên tử hiện đại, electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân. Đúng || Sai
(2) Tất cả các AO nguyên tử đều có hình dạng giống nhau. Sai || Đúng
(3) Mỗi AO nguyên tử chỉ có thể chứa được 1 electron. Sai || Đúng
(4) Các electron s chuyển động trong các AO có hình số tám nổi. Sai || Đúng
Mỗi phát biểu sau đây về mô hình nguyên tử hiện đại là đúng hay sai?
(1) Theo mô hình nguyên tử hiện đại, electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân. Đúng || Sai
(2) Tất cả các AO nguyên tử đều có hình dạng giống nhau. Sai || Đúng
(3) Mỗi AO nguyên tử chỉ có thể chứa được 1 electron. Sai || Đúng
(4) Các electron s chuyển động trong các AO có hình số tám nổi. Sai || Đúng
Phát biểu (1) đúng.
Phát biểu (2) sai vì AO s có dạng hình cầu, AO p có dạng hình số tám nổi.
Phát biểu (3) sai vì mỗi AO chứa tối đa 2 electron.
Phát biểu (4) sai vì AO s có dạng hình cầu.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau về nguyên tử ![]() , hãy chọn đúng hoặc sai:
, hãy chọn đúng hoặc sai:
(1) Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 28. Sai || Đúng
(2) Nguyên tử X có 4 lớp electron. Đúng || Sai
(3) Cấu hình electron của nguyên tử X là [Ar]3d44s2. Sai || Đúng
(4) X là kim loại. Đúng || Sai
Ở mỗi phát biểu sau về nguyên tử ![]() , hãy chọn đúng hoặc sai:
, hãy chọn đúng hoặc sai:
(1) Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 28. Sai || Đúng
(2) Nguyên tử X có 4 lớp electron. Đúng || Sai
(3) Cấu hình electron của nguyên tử X là [Ar]3d44s2. Sai || Đúng
(4) X là kim loại. Đúng || Sai
(1) sai. Tổng các hạt mang điện nhiều hơn số hạt không mang điện là:
P + E – N = 2P – (A – N) = 2.24 – (52 – 24) = 20.
(2) đúng. Cấu hình electron của X là: 1s22s22p63s23p63d54s1 ⇒ Nguyên tử X có 4 lớp electron.
(3) sai.
(4) đúng. Do X có 1 nguyên tố electron lớp ngoài cùng.
Ở mỗi phát biểu, hãy chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết. Sai || Đúng
(b) Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết σ. Đúng || Sai
(c) Liên kết σ kém bền vững hơn liên kết π. Sai || Đúng
(d) Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên. Đúng || Sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết. Sai || Đúng
(b) Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết σ. Đúng || Sai
(c) Liên kết σ kém bền vững hơn liên kết π. Sai || Đúng
(d) Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên. Đúng || Sai
(a) sai. Vẫn có thể có AO s xen phủ với AO p.
(b) đúng.
(c) sai. Liên kết σ bền vững hơn liên kết π.
(d) đúng.
Tìm nhận định đúng hoặc sai về X, Y
Nguyên tử X có tổng số electron điền vào phân lớp p là 11. Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8. Các nhận định sau về X, Y là đúng hay sai?
(a) Y có số thứ tự 13, chu kì 3, nhóm IIIA. Đúng || Sai
(b) X có số thứ tự 17, chu kì 3, nhóm VIIA. Đúng || Sai
(c) Hợp chất được tạo từ X và Y là XY3. Sai || Đúng
(d) X là kim loại, Y là phi kim. Sai || Đúng
Nguyên tử X có tổng số electron điền vào phân lớp p là 11. Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8. Các nhận định sau về X, Y là đúng hay sai?
(a) Y có số thứ tự 13, chu kì 3, nhóm IIIA. Đúng || Sai
(b) X có số thứ tự 17, chu kì 3, nhóm VIIA. Đúng || Sai
(c) Hợp chất được tạo từ X và Y là XY3. Sai || Đúng
(d) X là kim loại, Y là phi kim. Sai || Đúng
X có tổng số electron trong các phân lớp p là 11 nên cấu hình electron của X là: 1s22s22p63s23p5.
⇒ ZX = 17 hay PX = EX = 17.
Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8.
⇒ PY + EY = 17.2 – 8 = 26 ⇒ PY = 13 hay ZY = 13.
⇒ Cấu hình electron của X là: 1s22s22p63s23p1.
(a) đúng.
(b) đúng.
(c) sai. Hợp chất được tạo từ X và Y là YX3.
(d) sai. X là phi kim, Y là kim loại.
Tính khối lượng của nguyên tử fluorine theo đơn vị amu
Nguyên tử fluorine ![]() . Tính khối lượng của nguyên tử fluorine theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
. Tính khối lượng của nguyên tử fluorine theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
Nguyên tử fluorine ![]() . Tính khối lượng của nguyên tử fluorine theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
. Tính khối lượng của nguyên tử fluorine theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
mF = me + mp + mn = 9.0,00055 + 9.1 + 10.1 ≈ 19,00495 ≈ 19 amu.
Viết cấu hình, xác định số e độc thân, và dự đoán tính chất
Nguyên tố X (Z = 17) là nguyên tố hóa học có tính oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong xử lý nước cấp, nước bể bơi, dệt nhuộm,...
a) Viết cấu hình electron của X.
b) Xác định số electron độc thân của X ở trạng thái cơ bản.
c) Dự đoán tính chất hóa học cơ bản của X (kim loại, phi kim hay khí hiểm), giải thích?
Nguyên tố X (Z = 17) là nguyên tố hóa học có tính oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong xử lý nước cấp, nước bể bơi, dệt nhuộm,...
a) Viết cấu hình electron của X.
b) Xác định số electron độc thân của X ở trạng thái cơ bản.
c) Dự đoán tính chất hóa học cơ bản của X (kim loại, phi kim hay khí hiểm), giải thích?
a) ZX = 17 ⇒ Cấu hình electron của X là: 1s22s22p63s23p5.
b) Sự phân bố electron lớp ngoài cùng vào orbital nguyên tử:
⇒ Ở trạng thái cơ bản X có 1 electron độc thân
c) X là phi kim vì X có 7 elctron ở lớp ngoài cùng.
Xác định tên kim loại và tính nồng độ phần trăm của dung dịch
Khi cho 2,34 gam một kim loại M thuộc nhóm IA tác dụng hết với 50 gam nước thì thu được 0,7437 lít khí H2 ở điều kiện chuẩn (25oC, 1 bar).
a) Xác định tên kim loại M?
b) Tính nồng độ phần trăm của dung dịch tạo thành?
Khi cho 2,34 gam một kim loại M thuộc nhóm IA tác dụng hết với 50 gam nước thì thu được 0,7437 lít khí H2 ở điều kiện chuẩn (25oC, 1 bar).
a) Xác định tên kim loại M?
b) Tính nồng độ phần trăm của dung dịch tạo thành?
a)
Phương trình hóa học:
2M + 2H2O → 2MOH + H2↑
⇒ nM = 2nH2 = 0,06 (mol)
Vậy M là potassium (K).
b) nKOH = nK = 0,06 (mol) ⇒ mKOH = 0,06.56 = 3,36 (g)
⇒ mdd = mK + mH2O – mH2 = 2,34 + 50 – 0,03.2 = 52,28 (g)
Tính tổng năng lượng liên kết của các phân tử
Cho năng lượng liên kết của các loại liên kết như bảng sau:
| Liên kết | C–H | C–C | C=C | C≡C |
| Năng lượng liên kết (Eb, KJ/mol) |
413 | 347 | 614 | 839 |
Hãy tính tổng năng lượng liên kết của các phân tử sau:
a) 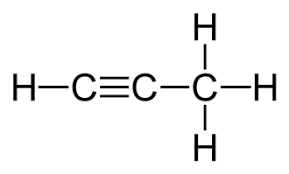
b) 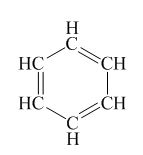
Cho năng lượng liên kết của các loại liên kết như bảng sau:
| Liên kết | C–H | C–C | C=C | C≡C |
| Năng lượng liên kết (Eb, KJ/mol) |
413 | 347 | 614 | 839 |
Hãy tính tổng năng lượng liên kết của các phân tử sau:
a) 
b) 
a) Tổng năng lượng liên kết của propyne:
E = 4EbC–H + EbC–C + EbC≡C = 4.413 + 347 + 839 = 2838 (KJ/mol)
Tổng năng lượng liên kết của benzene:
E = 6.EbC–H + 3.EbC–C + 3EbC=C = 6.413 + 3.347 + 3.614 = 5361 (KJ/mol)
Xác định tên nguyên tố R
Nguyên tố R tạo oxide cao nhất với oxygen có dạng RO2. Trong công thức hợp chất khí với hydrogen R chiếm 87,5% về khối lượng. Xác định tên nguyên tố R.
Nguyên tố R tạo oxide cao nhất với oxygen có dạng RO2. Trong công thức hợp chất khí với hydrogen R chiếm 87,5% về khối lượng. Xác định tên nguyên tố R.
R tạo oxide cao nhất với oxygen có dạng RO2, theo bảng tuần hoàn suy ra hợp chất khí với hydrogen của nguyên tố R là RH4.
⇒ MR = 28 (Si)
Vậy tên của R là silicon.
Dự đoán loại liên kết trong hợp chất A
Hợp chất A có dạng X2Y. Trong phân tử A, tổng số hạt proton là 46 và nguyên tố X chiếm 82,98% về khối lượng. Trong hạt nhân nguyên tử X có số hạt neutron nhiều hơn số hạt proton là 1 hạt, trong hạt nhân nguyên tử Y có số hạt mang điện bằng số hạt không mang điện. Dự đoán loại liên kết trong hợp chất A.
Hợp chất A có dạng X2Y. Trong phân tử A, tổng số hạt proton là 46 và nguyên tố X chiếm 82,98% về khối lượng. Trong hạt nhân nguyên tử X có số hạt neutron nhiều hơn số hạt proton là 1 hạt, trong hạt nhân nguyên tử Y có số hạt mang điện bằng số hạt không mang điện. Dự đoán loại liên kết trong hợp chất A.
Ta có: Tổng số hạt proton trong A là 46:
⇒ 2PX + PY = 46 hay 2.ZX + ZY = 46 (1)
Lại có: NX = ZX + 1; NY = ZY ⇒ 2NX + NY = 2(ZX + 1) + ZY = 48 (2)
⇒ MA = 2(ZX + NX) + ZY + NY = 2.ZX + ZY + 2NX + NY (3)
Thay (2) vào (3) ta có: MA = 46 + 48 = 94.
Mà X chiếm 82,98%:
⇒ MY = 94 – 39.2 = 16
Vậy hợp chất A là K2O, liên kết trong A là liên kết ion.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

