Số oxi hoá là một số đại số đặc trưng
Số oxi hoá là một số đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
Số oxi hoá là một số đại số đặc trưng cho điện tích của nguyên tử trong phân tử
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 10 tháng 2, cùng nhau luyện tập và xem kết quả nha!
Số oxi hoá là một số đại số đặc trưng
Số oxi hoá là một số đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
Số oxi hoá là một số đại số đặc trưng cho điện tích của nguyên tử trong phân tử
Xác định số electron dùng chung, số electron hóa trị riêng của N
Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung, số electron hóa trị riêng của N lần lượt là
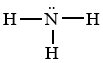
Từ công thức lewis của NH3 ta thấy số electron dùng chung là 6, số electron hóa trị riêng của N là 2.
Xác định loại phản ứng
Một phản ứng có = –890,3 kJ/mol. Đây là phản ứng
Phản ứng có < 0 là phản ứng tỏa nhiệt.
Xác định công thức oxide, hydroxide và tính chất
Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p4. Công thức oxide ứng với hoá trị cao nhất của X, hydroxide tương ứng và tính acid – base của chúng là
Cấu hình electron lớp ngoài cùng của X là 3s23p4.
⇒ X thuộc nhóm VIA ⇒ ông thức oxide ứng với hoá trị cao nhất của X là XO3.
⇒ Hydroxide tương ứng là H2XO4 và hydroxide có tính acid.
Yếu tố đặc trưng cho độ bền liên kết
Yếu tố nào đặc trưng cho độ bền của liên kết?
Năng lượng liên kết hóa học đặc trưng cho độ bền liên kết.
Dãy gồm các kim loại xếp theo chiều tăng dần tính kim loại
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p63s1; 1s22s22p63s2; 1s22s22p63s23p1. Dãy gồm các kim loại xếp theo chiều tăng dần tính kim loại từ trái sang phải là
X,Y, Z đều thuộc chu kì 3. Sắp xếp theo chiều tăng dần của điện tích hạt nhân X; Y; Z.
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần.
Vậy chiều tăng dần tính kim loại: Z, Y, X.
Xác định chất đóng vai trò là chất khử
Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau:
Fe2O3 + 3CO 2Fe + 3CO2
Trong phản ứng trên, chất đóng vai trò chất khử là
Ta có sự thay đổi số oxi hóa của các chất trong phản ứng:
Trong phân tử CO, nguyên tử C nhường 2 electron ⇒ CO là chất khử.
Công thức hợp chất oxide ứng với hóa trị cao nhất của N
Nguyên tố N (nitrogen) thuộc nhóm VA trong bảng tuần hoàn. Công thức hợp chất oxide ứng với hóa trị cao nhất của N là
N thuộc nhóm VA trong bảng tuần hoàn ⇒ Công thức hợp chất oxide ứng với hóa trị cao nhất của N là N2O5.
Xác định quá trình tạo thành ion viết đúng
Quá trình tạo thành ion nào sau đây được viết đúng?
Quá trình tạo thành ion được viết đúng là: Mg → Mg2+ + 2e.
Xác định tổng hệ số cân bằng của phản ứng
Cho phương trình hoá học: Cu + HNO3 → Cu(NO3)2 + NO + H2O
Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trong phản ứng:
Chất khử Chất oxi hóa
Quá trình oxi hóa:
Quá trình khử:
Cân bằng đúng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
⇒ Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là: 3 + 8 + 3 + 2 + 4 = 20.
Hợp chất tạo được liên kết hydrogen liên phân tử
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
H2O tạo được liên kết hydrogen vì liên O–H phân cực. Nguyên tử H mang một phần điện tích dương (linh động) của phân tử H2O này tương tác bằng lực hút tĩnh điện với nguyên tử O mang một phần điện tích âm của nguyên tử H2O khác.
Xác định phản ứng oxi hóa khử
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Trong phản ứng có sự thay đổi số oxi hóa của các nguyên tử nguyên tố Zn và H ⇒ là phản ứng oxi hóa khử.
Điều kiện nhiệt độ để xác định enthalpy tạo thành chuẩn
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) được xác định trong điều kiện nhiệt độ thường được chọn là
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) được xác định trong điều kiện nhiệt độ thường được chọn là 25oC (298K).
Xác định quá trình tỏa nhiệt
Trong các quá trình sau, quá trình nào là quá trình thu nhiệt?
Nung đá vôi: CaCO3 CaO + CO2 phản ứng cần cung cấp nhiệt độ trong toàn bộ quá trình, nếu ngừng cung cấp nhiệt phản ứng không xảy ra ⇒ phản ứng thu nhiệt.
Xác định nguyên tố thuộc nhóm
Nguyên tố nào sau đây thuộc nhóm A?
Nhóm A gồm các nguyên tố khối s, p.
⇒ [Ne]3s23p3 thuộc khối p nên thuộc nhóm A.
Xác định chất có enthalpy tạo thành chuẩn bằng 0
Cho các chất sau, chất nào có enthalpy tạo thành chuẩn bằng 0?
Các đơn chất bền có enthalpy tạo thành chuẩn bằng 0.
⇒ H2(g) có enthalpy tạo thành chuẩn bằng 0.
Phương trình hóa học biểu thị enthalpy tạo thành chuẩn của NH3(g)
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của NH3(g)?
Phương trình hóa học biểu thị enthalpy tạo thành chuẩn của NH3(g) là:
N2(g) + 3H2(g) → 2NH3(g).
Tính enthalpy tạo thành chuẩn của SO2(g)
Với nhiệt tạo thành chuẩn của đơn chất bằng 0 ta có:
(1) = 2.
(H2O) – 2.
(H2S) –
(SO2) = –237 (kJ)
(2) = 2.
(H2O) – 2.
(H2S) = –530,5 (kJ).
(2) –
(1) =
(SO2) = –530,5 – (–237) = –293,5 (kJ).
Tìm khẳng định không đúng
Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, thì điều khẳng định nào sau đây không đúng?
Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện của các nguyên tố giảm dần.
Tính số chất mà phân tử vừa có liên kết ion vừa có liên kết cộng hóa trị
Cho các chất: NH4Cl (1), Na2CO3 (2), NaF (3), H2CO3 (4), KNO3 (5), HClO (6), KClO (7). Trong các chất trên, số chất mà phân tử vừa có liên kết ion vừa có liên kết cộng hóa trị là :
NH4Cl: liên kết ion là của NH4+ và Cl–, liên kết cộng hóa trị giữa N và H.
Na2CO3: Liên kết ion của Na+ và CO32–, liên kết cộng hóa trị giữa C và O.
NaF: chỉ có liên kết ion giữa Na+ và F–.
H2CO3: chỉ có liên kết cộng hóa trị (giữa C và O hoặc O và H).
KNO3: liên kết ion giữa K+ và NO3–, liên kết cộng hóa trị giữa N và O.
HClO: chỉ có liên kết cộng hóa trị.
KClO: liên kết ion giữa K+ và ClO–, liên kết cộng hóa trị giữa Cl và O.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt. Đúng || Sai
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt. Sai || Đúng
(d) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng. Sai || Đúng
(e) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào. Sai || Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt. Đúng || Sai
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt. Sai || Đúng
(d) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng. Sai || Đúng
(e) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào. Sai || Đúng
(a) đúng.
(b) sai. Ví dụ: Phản ứng CaCO3 → CaO + CO2 là phản ứng thu nhiệt.
(c) sai. Lượng nhiệt mà phản ứng hấp thụ hay giải phóng phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng. Ví dụ:
Phản ứng: H2(g) + O2(g)→ H2O(g) có
= −241,8 kJ
Nhưng phản ứng: H2(g) + O2(g) → H2O(l) có
= −285,8kJ
(d) sai. vì sự cháy của nhiên liệu là những ví dụ về phản ứng tỏa nhiệt. Việc khơi mào ban đầu là cung cấp nhiệt ban đầu cho sự cháy nhưng sau đó phản ứng cháy có thể tự tiếp diễn và tỏa rất nhiều nhiệt.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Cho X, Y, T là ba nguyên tố liên tiếp nhau trong một chu kì (ZX < ZY < ZT). Tổng số các hạt mang điện trong nguyên tử của ba nguyên tố là 96.
(a) Độ âm điện tăng dần X < Y < T. Đúng || Sai
(b) X, Y, T đều thuộc chu kì 3. Đúng || Sai
(c) X là nguyên tố phi kim; Y, T đều là nguyên tố kim loại. Sai || Đúng
(d) Công thức hydroxide của Y là H2YO4. Đúng || Sai
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Cho X, Y, T là ba nguyên tố liên tiếp nhau trong một chu kì (ZX < ZY < ZT). Tổng số các hạt mang điện trong nguyên tử của ba nguyên tố là 96.
(a) Độ âm điện tăng dần X < Y < T. Đúng || Sai
(b) X, Y, T đều thuộc chu kì 3. Đúng || Sai
(c) X là nguyên tố phi kim; Y, T đều là nguyên tố kim loại. Sai || Đúng
(d) Công thức hydroxide của Y là H2YO4. Đúng || Sai
Ta có: Hạt mang điện trong nguyên tử gồm E và P.
Suy ra tổng số hạt mang điện bằng P + E = 2Z.
Vì X, Y, T là các nguyên tố liên tiếp trong cùng 1 chu kì nên ZY = ZX + 1 và ZT = ZX + 2.
Ta có tổng số hạt mang điện = 2ZX + 2ZY + 2ZT = 2ZX + 2(ZX + 1) + 2.(ZX + 2) = 96
⇒ ZX = 15 (P), ZY = 16 (S), ZT = 17 (Cl).
Cấu hình electron của: X: 1s22s22p63s23p3, Y: 1s22s22p63s23p4, T: 1s22s22p63s23p5.
(a) đúng. Trong một chu kì, độ âm điện tăng dần.
(b) đúng. X, Y, T có 3 lớp electron nên thuộc chu kì 3.
(c) sai. Các nguyên tố 5, 6 hoặc 7 electron lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim.
(d) đúng. Y thuộc nhóm VIA ⇒ Công thức hydroxide của Y là H2YO4.
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Xét phân tử H2O:
(a) Liên kết H – O là liên kết cộng hoá trị phân cực. Đúng || Sai
(b) Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử H. Sai || Đúng
(c) Nguyên tử O còn hai cặp electron hoá trị riêng. Đúng || Sai
(d) Nguyên tử O ở trạng thái lai hóa sp2. Sai || Đúng
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Xét phân tử H2O:
(a) Liên kết H – O là liên kết cộng hoá trị phân cực. Đúng || Sai
(b) Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử H. Sai || Đúng
(c) Nguyên tử O còn hai cặp electron hoá trị riêng. Đúng || Sai
(d) Nguyên tử O ở trạng thái lai hóa sp2. Sai || Đúng
(a) đúng.
(b) sai. O có độ âm điện cao hơn ⇒ Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
(c) đúng. Công thức Lewis của H2O là:

⇒ Nguyên tử O còn hai cặp electron hoá trị riêng.
(d) sai. Nguyên tử O ở trạng thái lai hóa sp3.
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Để hàn đường ray tàu hỏa bị hỏng, người ra dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) → Al2O3(s) + Fe(s).
a) Sản phẩm khử là Fe. Sai || Đúng
b) Fe2O3 là chất oxi hóa. Đúng || Sai
c) Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2 : 1. Sai || Đúng
d) Phản ứng tỏa rất nhiều nhiệt. Đúng || Sai
Ở mỗi phát biểu a), b), c), d), hãy chọn đúng hoặc sai.
Để hàn đường ray tàu hỏa bị hỏng, người ra dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) → Al2O3(s) + Fe(s).
a) Sản phẩm khử là Fe. Sai || Đúng
b) Fe2O3 là chất oxi hóa. Đúng || Sai
c) Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2 : 1. Sai || Đúng
d) Phản ứng tỏa rất nhiều nhiệt. Đúng || Sai
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
a) đúng.
b) đúng.
c) sai. Al nhường electron nên là chất khử (chất bị oxi hóa), nguyên tử Fe trong Fe2O3 nhận electron nên Fe2O3 là chất oxi hóa (chất bị khử).
⇒ Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 1 : 2.
d) đúng.
Viết cấu hình electron, xác định vị trí của X, Y
Cho các nguyên tố X (Z = 19); Y (Z = 8).
Viết cấu hình electron và xác định vị trí của X, Y trong bảng tuần hoàn (có giải thích); Chúng là nguyên tố phi kim, kim loại hay khí hiếm?
Cho các nguyên tố X (Z = 19); Y (Z = 8).
Viết cấu hình electron và xác định vị trí của X, Y trong bảng tuần hoàn (có giải thích); Chúng là nguyên tố phi kim, kim loại hay khí hiếm?
Cấu hình electron:
- X: 1s22s22p63s23p64s1
- Y: 1s22s22p4
Vị trí:
- X thuộc ô số 19, X có 1 e ở lớp ngoài cùng nên thuộc nhóm IA, X có 4 lớp electron nên thuộc chu kì 4.
- Tương tự, Y thuộc ô số 8, nhóm VIA, chu kì 2.
X có 1 electron lớp ngoài cùng ⇒ X là kim loại, Y có 6 electron lớp ngoài cùng ⇒ Y là phi kim.
Hãy xác định loại liên kết trong các chất
Cho độ âm điện các nguyên tố:
| Nguyên tố | H | F | O | N | S | Al | Ca |
| Độ âm điện ( |
2,20 | 3,98 | 3,44 | 3,04 | 2,58 | 1,61 | 1,00 |
Hãy xác định loại liên kết trong các chất sau: NH3, F2, Al2S3, CaO.
Cho độ âm điện các nguyên tố:
| Nguyên tố | H | F | O | N | S | Al | Ca |
| Độ âm điện ( |
2,20 | 3,98 | 3,44 | 3,04 | 2,58 | 1,61 | 1,00 |
Hãy xác định loại liên kết trong các chất sau: NH3, F2, Al2S3, CaO.
Xác định loại liên kết trong các phân tử: NH3, F2, Al2S3, CaO.
| Phân tử | Δ |
Loại liên kết |
| NH3 | 3,04 – 2,20 = 0,84 | CHT phân cực |
| F2 | 3,98 – 3,98 = 0 | CHT không phân cực |
| Al2S3 | 2,58 – 1,61 = 0,97 | CHT phân cực |
| CaO | 3,44 – 1,00 = 2,44 | Ion |
Cân bằng các phản ứng bằng phương pháp thăng bằng electron
Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) Mg + HNO3 → Mg(NO3)2 + N2 + H2O
Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) Mg + HNO3 → Mg(NO3)2 + N2 + H2O
a) Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Quá trình oxi hóa - khử:

Cân bằng đúng là: 2H2S + SO2 → 3S+ 2H2O
b) Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Quá trình oxi hóa - khử:

Cân bằng đúng là: 5Mg + 12HNO3 → 5Mg(NO3)2 + N2 + 6H2O
Xác định giá trị biến thiên enthalpy chuẩn của phản ứng
Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình:
H2(g) + Cl2(g) → 2HCl(g)
Xác định giá trị biến thiên enthalpy chuẩn của phản ứng.
(Biết năng lượng liên kết Eb(H–H) = 436 kJ/mol, Eb(Cl–Cl) = 243 kJ/mol, Eb(H–Cl) = 432 kJ/mol).
Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình:
H2(g) + Cl2(g) → 2HCl(g)
Xác định giá trị biến thiên enthalpy chuẩn của phản ứng.
(Biết năng lượng liên kết Eb(H–H) = 436 kJ/mol, Eb(Cl–Cl) = 243 kJ/mol, Eb(H–Cl) = 432 kJ/mol).
= [Eb(H–H) + Eb(Cl–Cl)] – 2.Eb(H–Cl)
= 436 + 243 – 2.432
= –185 kJ/mol
Tính thể tích khí NO tạo thành
Hòa tan hoàn toàn 7,2 gam magnesium vào dung dịch nitric acid loãng. Tính thể tích khí nitrogen monoxide (NO) tạo thành ở điều kiện chuẩn.
Hòa tan hoàn toàn 7,2 gam magnesium vào dung dịch nitric acid loãng. Tính thể tích khí nitrogen monoxide (NO) tạo thành ở điều kiện chuẩn.
nMg = 7,2/24= 0,3 mol
Quá trình nhường - nhận electron:
| | |
| mol: 0,3 → 0,6 | mol: 0,6 → 0,2 |
VNO = 0,2.24,79 = 4,958 (l)
Tính nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol
Ethanol sôi ở 78,29oC. Để làm 1 gam ethanol lỏng nóng thêm 1oC cần một nhiệt lượng là 1,44 J; để 1 gam ethanol hóa hơi (ở 78,29oC) cần một nhiệt lượng là 855 J. Hãy tính nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó.
Ethanol sôi ở 78,29oC. Để làm 1 gam ethanol lỏng nóng thêm 1oC cần một nhiệt lượng là 1,44 J; để 1 gam ethanol hóa hơi (ở 78,29oC) cần một nhiệt lượng là 855 J. Hãy tính nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó.
1 kg = 1000g
Nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0oC đến nhiệt độ sôi là:
1000.1,44.(78,29 – 20) = 83 937,6 (J)
Nhiệt lượng cần cung cấp để hóa hơi hoàn toàn 1 kg ethanol ở nhiệt độ sôi là:
855.1000 = 855 000 (J)
Nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó là:
83937,6 + 855000 = 938937,6 (J)
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

