Loại hạt được tìm thấy ở lớp vỏ nguyên tử
Loại hạt nào sau đây được tìm thấy ở lớp vỏ nguyên tử?
Loại hạt được tìm thấy ở lớp vỏ nguyên tử là electron.
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 10 tháng 9, cùng nhau luyện tập và xem kết quả nha!
Loại hạt được tìm thấy ở lớp vỏ nguyên tử
Loại hạt nào sau đây được tìm thấy ở lớp vỏ nguyên tử?
Loại hạt được tìm thấy ở lớp vỏ nguyên tử là electron.
Orbital nguyên tử
Orbital nguyên tử là
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Nguyên tố hóa học
Nguyên tố hóa học là những nguyên tử có cùng
Nguyên tố hóa học là những nguyên tử có cùng số proton.
Tìm phát biểu đúng
Dựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây là đúng?
- Số electron tối đa trên các lớp là khác nhau, ví dụ lớp thứ nhất có tối đa 2 electron; lớp thứ hai có tối đa 8 electron.
- Năng lượng của các electron trên các lớp khác nhau là khác nhau.
- Electron ở gần hạt nhân nhất có năng lượng thấp nhất.
Lớp electron có electron liên kết chặt chẽ với hạt nhân nhất
Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
Lớp K gần hạt nhân nhất, liên kết chặt chẽ nhất với hạt nhân.
Điện tích hạt nhân của P
Phosphorus là một chất có vai trò quan trọng trong nhiều các quá trình chuyển hóa của cơ thể, chẳng hạn như quá trình sinh tổng hợp các chất cơ bản của cơ thể như protein, carbohydrate, phospholipid màng tế bào, DNA, RNA. Với kí hiệu nguyên tử , P có điện tích hạt nhân là
Từ kí hiệu nguyên tử của P ta thấy AP = 31; ZP = 15 ⇒ Điện tích hạt nhân của P là +15.
Nguyên tử trung hòa về điện
Nguyên tử trung hòa về điện vì
Nguyên tử trung hòa về điện vì có tổng số hạt proton bằng tổng số hạt electron.
Hình vẽ mô tả thí nghiệm
Hình vẽ sau đây mô tả thí nghiệm tìm ra
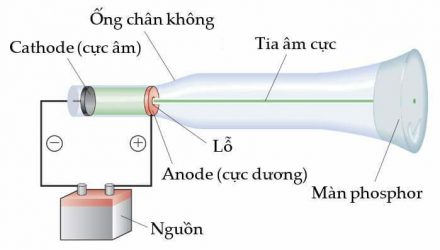
Hình vẽ trên mô tả thí nghiệm tìm ra hạt electron.
Điện tích của neutron
Điện tích của neutron là
Neutron là hạt không mang điện tích.
Nguyên tố có kí hiệu là H
Nguyên tố nào sau đây có kí hiệu là H?
Nguyên tố hydrogen có kí hiệu là H.
Tính số hạt electron trong nguyên tử sodium
Trong nguyên tử sodium (Na), số hạt mang điện tích dương là 11, số hạt không mang điện là 12. Số hạt electron trong nguyên tử sodium là bao nhiêu?
Số hạt mang điện tích dương là P = 11, mà trong nguyên tử P = E ⇒ số hạt electron trong nguyên tử sodium là 11.
Tính số loại phân tử khí carbon dioxide được tạo thành
Oxygen có 3 đồng vị ,
,
. Carbon có hai đồng vị là:
,
. Hỏi có thể có bao nhiêu loại phân tử khí carbon dioxide được tạo thành?
Mỗi phân tử khí CO2 có 1 nguyên tử C và 2 nguyên tử O. Để chọn ra 2 trong 3 nguyên tử thì có 6 cách chọn, để chọn ra 1 trong số 2 nguyên tử C thì có 2 cách chọn.
Vậy số phân tử CO2 được tạo thành từ các đồng vị của C và O là 6.2 = 12.
Số electron có cùng năng lượng ở lớp thứ nhất của nguyên tử O
Nguyên tử O có 8 electron. Theo mô hình Rutherford – Bohr, nguyên tử O có số electron có cùng năng lượng ở lớp thứ nhất là
O có số electron tối đa ở lớp thứ nhất là: 2.
Tỉ lệ số lượng electron trên hai lớp
Nguyên tử N có 7 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
Số lượng electron tối đa trên một lớp là 2.n2 (với n ≤ 4).
Lớp thứ nhất của F chứa tối đa 2 electron.
Lớp thứ hai của F chứa 7 – 2 = 5 electron (lớp thứ hai tối đa chứa 2.22 = 8 electron).
Vậy tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là:
5 : 2.
Tính số nguyên tử carbon có trong cục than
Nguyên tử carbon có 6 proton, 6 neutron và 6 electron. Số nguyên tử carbon có trong cục than ứng với 24 gam carbon là
AC = 6 + 6 = 12
Trong 24 gam C có:
⇒ Số nguyên tử carbon có trong cục than là: 2.6,02.1023 = 1204.1023 (nguyên tử).
Xác định các phát biểu đúng
Hình ảnh dưới đây mô tả AO p với hai thùy:
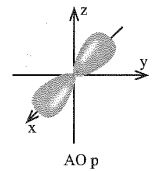
Những phát biểu nào sau đây là đúng?
(a) Xác suất tìm thấy electron ở mỗi thùy là khoảng 45%.
(b) Xác suất tìm thấy electron ở mỗi thùy là khoảng 90%.
(c) Xác suất tìm thấy electron trong AO p là khoảng 90%.
(d) Xác suất tìm thấy electron trong AO p là khoảng 45%.
Phát biểu đúng là: (a) và (c)
Xác suất tìm thấy electron trong AO p là khoảng 90% nên xác suất tìm thấy electron ở mỗi thùy là khoảng 45%.
Tổng số hạt proton, neutron và electron có trong nguyên tử
Tổng số hạt proton, neutron và electron có trong nguyên tử là
Tổng số hạt proton, neutron và electron có trong nguyên tử là:
N + P + E = (A – P) + P + E = 86 – 37 + 37 + 37 = 123
Xác định số lượng proton và electron trong ion NO3–
Nguyên tử N có 7 proton, nguyên tử O có 8 proton. Số lượng proton và electron trong ion NO3– lần lượt là:
Trong ion NO3– có 1 nguyên tử N và 3 nguyên tử O.
Số proton trong ion bằng: pN + 3pO = 7 + 3.8 = 31
Số electron trong ion bằng: 31 + 1 = 32
Tính giá trị số khối A của đồng vị
Neon có 3 đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử của mỗi đồng vị được thể hiện trong bảng sau:
| Số khối | A | 21 | 22 |
| Tỉ lệ % | 90,9 | 0,3 | 8,8 |
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
Áp dụng công thức tính nguyên tử khối trung bình có:
Tính bán kính nguyên tử gần đúng của iron ở 20oC
Trong tinh thể iron, các nguyên tử iron là những hình cầu chiếm 75% thể tích toàn khối tinh thể, phần còn lại là các khe rỗng giữa các quả cầu. Khối lượng nguyên tử của iron là 55,85 g/mol. Tính bán kính nguyên tử gần đúng của iron ở 20oC biết khối lượng riêng của iron tại nhiệt độ này là 7,87 g/cm3.
1 mol Fe có thể tích:
Thể tích của 1 nguyên tử Fe:
Bán kính nguyên tử:
Ở mỗi phát biểu chọn đúng hoặc sai
Ở mỗi phát biểu sau chọn đúng hoặc sai:
(a) Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu. Đúng || Sai
(b) Có những nguyên tử không chứa neutron nào. Đúng || Sai
(c) Một số nguyên tử không có bất kì proton nào. Sai || Đúng
(c) Khôi lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng electron. Đúng || Sai
Ở mỗi phát biểu sau chọn đúng hoặc sai:
(a) Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu. Đúng || Sai
(b) Có những nguyên tử không chứa neutron nào. Đúng || Sai
(c) Một số nguyên tử không có bất kì proton nào. Sai || Đúng
(c) Khôi lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng electron. Đúng || Sai
(a) đúng.
(b) đúng.
(c) sai vì nguyên tử bắt buộc phải có proton.
(d) đúng.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Trong một ô orbital có tối đa 2 electron có chiều tự quay ngược nhau. Sai || Đúng
(b) Các electron được sắp xếp vào các ô orbital sao cho số electron độc thân là cực đại. Đúng || Sai
(c) Trong nguyên tử các electron được sắp xếp theo mức năng lượng từ thấp đến cao. Đúng || Sai
(d) AO s có dạng hình số tám nổi. Sai || Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Trong một ô orbital có tối đa 2 electron có chiều tự quay ngược nhau. Sai || Đúng
(b) Các electron được sắp xếp vào các ô orbital sao cho số electron độc thân là cực đại. Đúng || Sai
(c) Trong nguyên tử các electron được sắp xếp theo mức năng lượng từ thấp đến cao. Đúng || Sai
(d) AO s có dạng hình số tám nổi. Sai || Đúng
(a) sai. Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
(b) đúng.
(c) đúng.
(d) sai. AO s có dạng hình cầu.
Ở mỗi ý a), b), c), d), hãy chọn đúng hoặc sai
Ở mỗi ý a), b), c), d), hãy chọn đúng hoặc sai.
Biết rằng một loại nguyên tử đồng (Cu) có 29 proton và 34 neutron. Những phát biểu nào sau đây là đúng?
a) Nguyên tử đồng có 29 electron. Đúng || Sai
b) Hạt nhân nguyên tử đồng trên có tổng số hạt là 63. Đúng || Sai
c) Ion Cu+ có 28 electron. Đúng || Sai
d) Ion Cu+ có 35 neutron. Sai || Đúng
Ở mỗi ý a), b), c), d), hãy chọn đúng hoặc sai.
Biết rằng một loại nguyên tử đồng (Cu) có 29 proton và 34 neutron. Những phát biểu nào sau đây là đúng?
a) Nguyên tử đồng có 29 electron. Đúng || Sai
b) Hạt nhân nguyên tử đồng trên có tổng số hạt là 63. Đúng || Sai
c) Ion Cu+ có 28 electron. Đúng || Sai
d) Ion Cu+ có 35 neutron. Sai || Đúng
a) đúng vì nguyên tử đồng có số electron = số proton = 29.
b) đúng vì số hạt trong hạt nhân nguyên tử đồng = 29 + 34 = 63.
c) đúng vì Cu nhường 1 electron tạo ion Cu+. Số electron của Cu+ = 29 – 1 = 28.
d) sai vì số neutron của ion Cu+ là 34 neutron.
Ở mỗi phát biểu, chọn đúng hoặc sai
Cho 3 nguyên tử: ![]() ,
, ![]() ,
, ![]() . Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
. Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) X, Y thuộc cùng một nguyên tố hóa học. Sai || Đúng
(b) X và Z có cùng số khối. Đúng || Sai
(c) X và Y có cùng số neutron. Sai || Đúng
(d) X, Z là 2 đồng vị của cùng một nguyên tố hóa học. Sai || Đúng
Cho 3 nguyên tử: ![]() ,
, ![]() ,
, ![]() . Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
. Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) X, Y thuộc cùng một nguyên tố hóa học. Sai || Đúng
(b) X và Z có cùng số khối. Đúng || Sai
(c) X và Y có cùng số neutron. Sai || Đúng
(d) X, Z là 2 đồng vị của cùng một nguyên tố hóa học. Sai || Đúng
(a) sai. X và Y có số proton khác nhau nên không thuộc cùng một nguyên tố hóa học.
(b) đúng.
(c) sai. X có số neutron N = 26 – 13 = 13, Y có số neutron N = 55 – 26 = 29.
(d) sai. X và Y có số proton khác nhau ⇒ không cùng thuộc một nguyên tố hóa học.
Viết kí hiệu nguyên tử của Y
Nguyên tử của nguyên tố Y có tổng số hạt cơ bản là 58, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 18. Viết kí hiệu nguyên tử của Y (dạng ![]() ).
).
Nguyên tử của nguyên tố Y có tổng số hạt cơ bản là 58, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 18. Viết kí hiệu nguyên tử của Y (dạng ![]() ).
).
Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là p, n và e.
Theo bài ta có:
Do e = p nên ta có:
⇒ Y có dạng:
Xác định số proton, số neutron, số electron, điện tích hạt nhân
Cho các nguyên tử có kí hiệu như sau: ![]() và
và ![]() . Hãy xác định số proton, số neutron, số electron và điện tích hạt nhân nguyên tử của chúng.
. Hãy xác định số proton, số neutron, số electron và điện tích hạt nhân nguyên tử của chúng.
Cho các nguyên tử có kí hiệu như sau: ![]() và
và ![]() . Hãy xác định số proton, số neutron, số electron và điện tích hạt nhân nguyên tử của chúng.
. Hãy xác định số proton, số neutron, số electron và điện tích hạt nhân nguyên tử của chúng.
P = E = 11; N = A – Z = 23 –11 = 12, ĐTHN = +11
P = E = 26; N = A – Z = 56 – 26 = 30, ĐTHN = +26
Tính khối lượng của nguyên tử sodium theo đơn vị amu
Nguyên tử sodium ![]() . Tính khối lượng của nguyên tử sodium theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
. Tính khối lượng của nguyên tử sodium theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
Nguyên tử sodium ![]() . Tính khối lượng của nguyên tử sodium theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
. Tính khối lượng của nguyên tử sodium theo đơn vị amu (biết me ≈ 0,00055 amu, mp ≈ mn ≈ 1 amu).
Khối lượng của nguyên tử sodium theo đơn vị amu là:
mNa = me + mp + mn = 11.0,00055 + 11.1+ 12.1 ≈ 23,00605 ≈ 23 amu.
Xác định số nguyên tử của đồng vị 2H
Hydrogen có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị ![]() trong 18,016 ml nước?
trong 18,016 ml nước?
Biết: Trong nước chỉ có hai đồng vị ![]() và
và ![]() ; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxygen bằng 16; số Avogadro N = 6,02.1023.
; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxygen bằng 16; số Avogadro N = 6,02.1023.
Hydrogen có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị ![]() trong 18,016 ml nước?
trong 18,016 ml nước?
Biết: Trong nước chỉ có hai đồng vị ![]() và
và ![]() ; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxygen bằng 16; số Avogadro N = 6,02.1023.
; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxygen bằng 16; số Avogadro N = 6,02.1023.
Gọi x và y lần lượt là phần trăm (%) của đồng vị và
, ta có:
x + y = 100 (1)
Từ (1) và (2) ⇒ x = 99,2; y = 0,8
Trong 18,016 ml nước có mH2O = D.V = 18,06 gam ⇒ nH2O = 1,003 (mol)
⇒ Số nguyên tử H trong 1,003 mol nước là:
2.1,003.6,02.1023 = 1,208.1024 (nguyên tử)
⇒ Số nguyên tử của đồng vị trong 18,016 ml nước là:
1,208.1024.0,8% = 9,664.1021 (nguyên tử)
Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium
Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích z của các đồng vị zirconium đều bằng 1+).
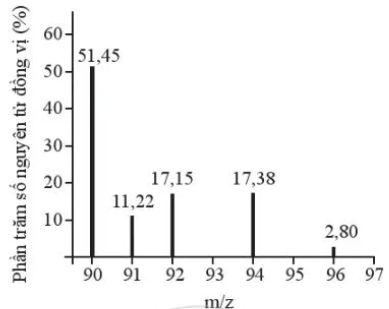
Xác định số lượng đồng vị bền và nguyên tử khối trung bình của zirconium.
Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích z của các đồng vị zirconium đều bằng 1+).

Xác định số lượng đồng vị bền và nguyên tử khối trung bình của zirconium.
Quan sát phổ khối lượng của zirconium xác định được nguyên tố này có 5 đồng vị.
Nguyên tử khối trung bình của zirconium là:
Tìm công thức phân tử của Z
Hợp chất Z có công thức M3R trong đó R chiếm 6,667% khối lượng. Nguyên tử M có số hạt neutron nhiều hơn hạt proton là 4, nguyên tử R có số neutron bằng proton Biết rằng tổng số hạt proton trong phân tử Z bằng 84. Tìm công thức phân tử của Z.
Hợp chất Z có công thức M3R trong đó R chiếm 6,667% khối lượng. Nguyên tử M có số hạt neutron nhiều hơn hạt proton là 4, nguyên tử R có số neutron bằng proton Biết rằng tổng số hạt proton trong phân tử Z bằng 84. Tìm công thức phân tử của Z.
Gọi n1, p1, và n2, p2 lần lượt là số proton và số neutron của nguyên tử M và R.
Tổng số hạt proton trong Z là: 3p1 + p2 = 84 (1)
Nguyên tử M có số hạt neutron nhiêu hơn hạt proton là 4 nên:
⇒ MM = AM = p1 + n1 = p1 + p1 + 4 = 2p1 + 4
Nguyên tử R có số neutron bằng proton nên:
⇒ MR = AR = n2 + p2 = 2p2
Từ (1) và (2) ⇒ p1 = 26, p2 = 6
⇒ M là Fe; R là C
⇒ Z là Fe3C.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

