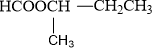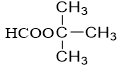Lý thuyết hóa 12 học kì 1 đầy đủ chi tiết nhất
Lý thuyết hóa hữu cơ 12
Lý thuyết hóa 12 học kì 1 đầy đủ chi tiết nhất được VnDoc biên soạn gửi tới bạn đọc là toàn bộ kiến thức hóa học 12 kì 1 về phần hữu cơ. Nội dung được xây dựng mở rộng theo cấu trúc nội dung lý thuyết sách giáo khoa. Mời các bạn cùng theo dõi bài viết dưới đây.
Một số kiến thức ôn tập trước khi vào bài este
Bảng 1: Tên gọi của 1 số axit thường gặp
|
Công thức cấu tạo |
Tên thường |
Tên thay thế |
|
HCOOH |
Axit fomic |
Axit metanoic |
|
CH3COOH |
Axit axetic |
Axit etanoic |
|
C2H5COOH |
Axit propionic |
Axit propanoic |
|
CH3CH2CH2COOH |
Axit butiric |
Axit butanoic |
 |
Axit isobutiric |
Axit 2-metylpropanoic |
|
CH3CH2CH2CH2COOH |
Axit valeric |
Axit pentanoic |
|
CH3CH2CH2CH2CH2COOH |
Axit caproic |
Axit hexanoic |
|
CH3CH2CH2CH2CH2CH2COOH |
Axit enangtoic |
Axit heptanoic |
|
(COOH)2 |
Axit oxalic |
Axit etan đioic |
|
CH2(COOH)2 |
Axit malonic |
Axit propan đioic |
|
(CH2)2(COOH)2 |
Axit sucxinic |
Axit butan đioic |
|
(CH2)3(COOH)2 |
Axit glutaric |
Axit pentan đioic |
|
CH2=CH-COOH |
Axit acrylic |
Axit propenoic |
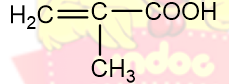 |
Axit metacylic |
Axit 2-metylpropenoic |
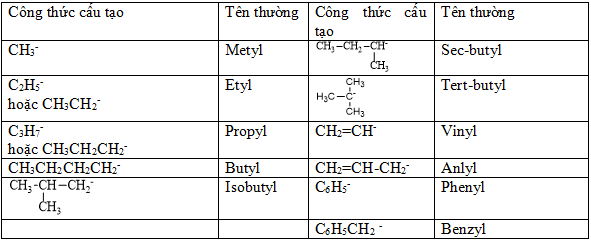
Bảng 2: Tên gọi của 1 số gốc thường gặp
CHƯƠNG I : ESTE – LIPIT
BÀI 1 : ESTE
I. Khái niệm: Khi thay thế nhóm OH- trong phân tử axit cacboxylic bằng nhóm OR’ của phân tử ancol, ta thu được este.
Ví dụ: CH3COOH + C2H5OH ![]() \(\overset{t^{\circ },H_{2} SO_{4}đn }{\rightleftharpoons}\) CH3COOC2H5 + H2O
\(\overset{t^{\circ },H_{2} SO_{4}đn }{\rightleftharpoons}\) CH3COOC2H5 + H2O
Tổng quát RCOOH + R’OH ![]() \(\overset{t^{\circ },H_{2} SO_{4}đn }{\rightleftharpoons}\) RCOOR’ + H2O
\(\overset{t^{\circ },H_{2} SO_{4}đn }{\rightleftharpoons}\) RCOOR’ + H2O
II. Đồng phân, danh pháp:
RCOOR’ (R là H hoặc gốc hiđrocacbon , R’ là gốc hiđrocacbon )
Cách gọi: “Tên gốc hiđrocacbon R’ + tên anion gốc axit (gọi theo tên thường của axit, đuôi ic => at )”
1/ Este no, đơn chức, mạch hở:
CnH2nO2 (n ≥ 2) hoặc CnH2n+1COOCmH2m+1 (n ≥ 0 , m ≥ 1)
- n = 2: C2H4O2 (1 este) HCOOCH3: metyl fomiat (metyl fomat)
- n = 3: C3H6O2 (2 este) HCOOC2H5: etyl fomat và CH3COOCH3: metyl axetat
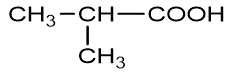
- n = 4: C4H8O2 (4 este)
| HCOOCH2CH2CH3 propyl fomat |
isopropyl fomat |
CH3COOC2H5 etyl axetat |
C2H5COOCH3 metyl propionat |
n = 5 : C5H10O2 (9 este)
|
HCOOCH2CH2CH2CH3 butyl fomat |
sec-butyl fomat |
isobutyl fomat |
|
tert-butyl fomat |
CH3COOCH2CH2CH3 propyl axetat |
ispropyl axetat |
|
C2H5COOCH2CH3 metyl propionat |
CH3CH2CH2COOCH3 metyl butirat |
metyl isobutirat |
2. Este không no, đơn chức, mạch hở, 1 nối đôi C=C: CnH2n-2O2 (n ≥ 3)
+ n = 3: C3H4O2 (1 este) HCOOCH=CH2: vinyl fomat
+ n = 4: C4H6O2 (5 este)
Ngoài ra, este C4H6O4 còn đồng phân 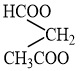
và este C5H8O4 còn đồng phân 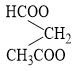 không thuộc hai dạng phân loại ở trên.
không thuộc hai dạng phân loại ở trên.
III. Tính chất vật lí
Các este là chất lỏng hoặc rắn ở điều kiện thường.
Các este có mùi thơm đặc trưng: isoamyl axetat CH3COOCH2CH2CH(CH3)2 có mùi chuối chín, etyl butirat CH3CH2CH2COOC2H5 và etyl propionat CH3CH2COOC2H5 có mùi dứa, geranyl axetat có mùi hoa hồng, benzyl axetat CH3COOCH2C6H5 có mùi hoa nhài....
Không tan trong nước, nhẹ hơn nước. Thường có t0 sôi và độ tan trong nước thấp hơn hẳn các axit và ancol cùng số cacbon hoặc cùng phân tử khối (nguyên nhân: không tạo được liên kết hiđrô giữa este với nước và este với nhau).
IV. Tính chất hóa học
1/ Phản ứng thủy phân: (phản ứng đặc trưng của este)
a/ Thủy phân trong môi trường axit:
Ví dụ: CH3COOC2H5 + H2O ![]() \(\overset{t^{\circ } , H_{2} SO_{4} đn}{\rightleftharpoons}\)CH3COOH + C2H5OH
\(\overset{t^{\circ } , H_{2} SO_{4} đn}{\rightleftharpoons}\)CH3COOH + C2H5OH
Tổng quát: RCOOR’ + H2O ![]() \(\overset{t^{\circ } , H_{2} SO_{4} đn}{\rightleftharpoons}\)RCOOH + R’OH
\(\overset{t^{\circ } , H_{2} SO_{4} đn}{\rightleftharpoons}\)RCOOH + R’OH
Đặc điểm: phản ứng thuận nghịch (2 chiều), cần xúc tác là H2SO4 và nhiệt độ cao.
(vì phản ứng thuận nghịch nên este vẫn còn dư và tạo thành hai chất lỏng → tách lớp )
b/ Thủy phân trong môi trường kiềm: (phản ứng xà phòng hóa)
Ví dụ: CH3COOC2H5 + NaOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) CH3COONa + C2H5OH
\(\overset{t^{\circ } }{\rightarrow}\) CH3COONa + C2H5OH
Tổng quát: RCOOR’ + NaOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) RCOONa + R’OH
\(\overset{t^{\circ } }{\rightarrow}\) RCOONa + R’OH
Đặc điểm: phản ứng 1 chiều (không thuận nghịch) , xảy ra ở nhiệt độ cao.
(vì phản ứng 1 chiều nên este hết → sản phẩm đồng nhất )
(**) Một số phản ứng đặc biệt:
c/ Este có dạng anđêhit: RCOOCH=CH-R’ (R và R’ là H hoặc các gốc hiđrôcacbon)
- Khi thủy phân trong môi trường axit: sinh ra axit và anđêhit
Ví dụ: CH3COOCH=CH2 + H2O ![]() \(\overset{t^{\circ },H_{2} SO_{4} }{\rightleftharpoons}\)CH3COOH + CH3CHO
\(\overset{t^{\circ },H_{2} SO_{4} }{\rightleftharpoons}\)CH3COOH + CH3CHO
- Khi thủy phân trong môi trường bazơ: sinh ra muối và anđêhit
Ví dụ: HCOOCH=CH-CH3 + NaOH ![]() \(\overset{t^{\circ } }{\rightarrow}\)HCOONa + CH3CH2CHO
\(\overset{t^{\circ } }{\rightarrow}\)HCOONa + CH3CH2CHO
d/ Este đơn chức của phenol: cộng NaOH hoặc KOH tỉ lệ 1:2, sản phẩm tạo 2 muối và nước.
RCOOC6H4R’ + 2NaOH → RCOONa + R’C6H4ONa + H2O
Ví dụ: CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa + H2O
HCOOC6H4CH3 + 2NaOH → HCOONa + CH3C6H4ONa + H2O
e/ Este tráng bạc: có dạng HCOOR (R bất kì)
f/ Phản ứng ở gốc hiđrôcacbon: các este không no có phản ứng ở gốc hiđrôcacbon (phản ứng cộng dung dịch Br2, phản ứng trùng hợp ...)
g/ Phản ứng cháy: este no đơn hở CnH2nO2 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
\(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
V/ Điều chế:
- Các este thường được điều chế bằng cách đun sôi hỗn hợp ancol và axit cacboxylic, có mặt H2SO4 đặc làm xúc tác (phản ứng este hóa)
RCOOH + R’OH ![]() \(\overset{t^{\circ },H_{2} SO_{4} }{\rightleftharpoons}\)RCOOR’ + H2O
\(\overset{t^{\circ },H_{2} SO_{4} }{\rightleftharpoons}\)RCOOR’ + H2O
- Một số este có phương pháp điều chế riêng:
Vinyl axetat: CH3COOH + CH≡CH ![]() \(\overset{t^{\circ },xt }{\rightarrow}\) CH3COOCH=CH2
\(\overset{t^{\circ },xt }{\rightarrow}\) CH3COOCH=CH2
Este của phenol: C6H5OH + (CH3CO)2O → CH3COOC6H5 + CH3COOH
Anhidrit axetic phenyl axetat
VI. Ứng dụng:
Do có khả năng hòa tan tốt nhiều chất nên một số este được dùng làm dung môi để tách, chiết chất hữu cơ (etyl axetat), pha sơn (butyl axetat).
Một số polime của este được dùng làm chất dẻo: poli (vinyl axetat), poli (metyl metacrylat)...
Một số este có mùi thơm, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm (benzyl fomat, etyl fomat,... ), mĩ phẩm (linalyl axetat, geranyl axetat,...)
BÀI II : LIPIT
I. Khái niệm: Lipit là những hợp chất hữu cơ có trong tế bào sống, không hòa tan trong nước nhưng tan nhiều trong dung môi hữu cơ không phân cực.
Về mặt cấu tạo, phần lớn lipit là các este phức tạp, bao gồm chất béo (còn gọi là triglixerit), sáp, steroit và photpholipit,...
II. Chất béo:
1. Khái niệm: chất béo là trieste của glixerol với các axit béo, gọi chung là triglixerit hay triaxylglixerol.
Axit béo là axit đơn chức có mạch cacbon dài, không phân nhánh, số C chẵn (từ 12 → 24)
Công thức cấu tạo chung của chất béo :
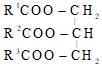
Trong đó R1 , R2 , R3 là các gốc hiđrocacbon, có thể giống nhau hoặc khác nhau.
Các axit béo và chất béo thường gặp:
| Axit béo | Chất béo |
| C15H31COOH hoặc (CH3[CH2]14COOH) hoặc C16H32O2: axit panmitic (axit no, k = 1) | (C15H31COO)3C3H5 hoặc C51H98O6: tripanmitin (tripanmitoylglixerol ) (k = 3) |
| C17H35COOH hoặc (CH3[CH2]16COOH) hoặc C18H36O2: axit stearic (axit no, k = 1) | (C17H35COO)3C3H5 hoặc C57H110O6: tristearin (tristearoylglixerol ) (k = 3) |
| C17H33COOH hoặc (cis CH3[CH2]7CH=CH[CH2]7COOH) hoặc C18H34O2: axit oleic (axit không no, 1 nối đôi C=C, k = 2) |
(C17H33COO)3C3H5 hoặc C57H104O6: Triolein (trioleoylglixerol) (k = 6) |
| C17H33COOH hoặc (cis – CH3[CH2]7CH=CH[CH2]7COOH) hoặc C18H34O2: axit oleic (axit không no, 1 nối đôi C=C, k = 2) |
(C17H33COO)3C3H5 hoặc C57H104O6: Triolein (trioleoylglixerol) (k = 6) |
| C17H31COOH hoặc C18H32O2: axit linoleic (axit không no, 2 nối đôi C=C, k = 3) | (C17H31COO)3C3H5 hoặc C57H98O6: trilinolein (trilinoleoylglixerol) (k = 9) |
| Với k là tổng số liên kết pi trong chất béo | |
2. Tính chất vật lí:
- Ở nhiệt độ thường, chất béo ở trạng thái lỏng hoặc rắn.
(C15H31COO)3C3H5 và (C17H35COO)3C3H5 là chất rắn (mỡ).
(C17H33COO)3C3H5 và (C17H31COO)3C3H5 là chất lỏng (dầu).
- Nhẹ hơn nước, không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ như benzen, hexan, clorofom, ...
3. Tính chất hóa học
a/ Phản ứng thủy phân:
(C17H35COO)3C3H5 + 3H2O ![]() \(\overset{t^{o} , H^{+} }{\rightleftharpoons}\)3C17H35COOH + C3H5(OH)3
\(\overset{t^{o} , H^{+} }{\rightleftharpoons}\)3C17H35COOH + C3H5(OH)3
tristearin axit stearic glixerol
b/ Phản ứng xà phòng hóa :
(C17H35COO)3C3H5 + 3NaOH ![]() \(\overset{t^{o} }{\rightarrow}\)3C17H35COONa + C3H5(OH)3
\(\overset{t^{o} }{\rightarrow}\)3C17H35COONa + C3H5(OH)3
tristearin natri stearat glixerol
Vì muối natri stearat làm xà phòng, nên phản ứng này được gọi là phản ứng xà phòng hóa.
c/ Phản ứng cộng hiđro của chất béo lỏng :
(C17H33COO)3C3H5 + 3H2 ![]() \(\xrightarrow[175-190^{o} C]{Ni}\)(C17H35COO)3C3H5
\(\xrightarrow[175-190^{o} C]{Ni}\)(C17H35COO)3C3H5
Phản ứng này được dùng trong công nghiệp để chuyển hóa chất béo lỏng (dầu) thành mỡ rắn, thuận tiện cho việc vận chuyển hoặc thành bơ nhân tạo và để sản xuất xà phòng.
** Dầu mỡ để lâu thường có mùi khó chịu (hôi, khét) mà ta gọi là hiện tượng mỡ bị ôi. Nguyên nhân của hiện tượng này là do liên kết đôi C=C ở gốc axit không no của chất béo bị oxi hóa chậm bởi oxi trong không khí thành peoxit, chất này bị phân hủy thành các anđêhit có mùi khó chịu và gây hại cho người ăn. Sau khi đã được dùng để rán, dầu mỡ cũng bị oxi hóa một phần thành anđêhit, nên nếu dùng lại dầu mỡ này thì không đảm bảo vệ sinh an toàn thực phẩm.
4. Vai trò và ứng dụng
Vai trò : thức ăn quan trọng của con người, nguồn cung cấp và dự trữ năng lượng, nguyên liệu tổng hợp chất hữu cơ khác, đảm bảo sự vận chuyển và hấp thụ các chất hòa tan được trong chất béo.
Ứng dụng : điều chế xà phòng, glixerol, chế biến thực phẩm. Dầu thực vật → động cơ điezen.
CHƯƠNG 2: CACBOHIĐRAT
I/ Khái niệm: Cacbohiđrat là những hợp chất hữu cơ tạp chức và thường có công thức chung là Cn(H2O)m .
II/ Phân loại: Cacbohiđrat được phân thành 3 nhóm sau :
Monosaccarit (đường đơn) : là nhóm cacbohiđrat đơn giản nhất, không thể thủy phân được. Thí dụ : glucozơ và fructozơ.
Đisaccarit (đường đôi) : là nhóm cacbohiđrat mà khi thủy phân mỗi phân tử sinh ra hai phân tử monosaccarit. Thí dụ : saccarozơ, mantozơ.
Polisaccarit (đường đa) : là nhóm cacbohiđrat phức tạp, khi thủy phân đến cùng mỗi phân tử sinh ra nhiều phân tử monosaccarit. Thí dụ : tinh bột và xenlulozơ.
I. MONOSACCARIT
| GLUCOZƠ | FRUCTOZƠ | |
| I/ Tính chất vật lí |
Chất rắn, tinh thể không màu, dễ tan trong nước, vị ngọt không ngọt bằng đường mía. - Có hầu hết trong các bộ phận của cây như lá, hoa, rễ,... và nhất là trong quả chín. Có trong cơ thể người và động vật. Có nhiều trong quả nho nên gọi là đường nho. Trong mật ong : khoảng 30%, trong máu người : nồng độ không đổi khoảng 0,1%. |
Chất kết tinh, không màu, dễ tan trong nước, có vị ngọt hơn đường mía, có nhiều trong quả ngọt như xoài, dứa ,... Đặc biệt trong mật ong có tới 40% fructozơ làm cho mật ong có vị ngọt sắc. |
| Ii/ Cấu trúc phân tử |
Dạng mạch hở : - Dữ kiện thực nghiệm xác định cấu tạo của glucozơ : + Glucozơ có phản ứng tráng bạc và bị oxi hóa bởi nước brom tạo thành axit gluconic, chứng tỏ phân tử có nhóm CHO. + Glucozơ tác dụng Cu(OH)2 ở t0 thường, cho dd xanh lam, chứng tỏ glucozơ có nhiều nhóm OH ở vị trí kề nhau. + Glucozơ tạo este chứa 5 gốc axit CH3COO chứng tỏ phân tử có 5 nhóm OH. + Khử hoàn toàn glucozơ thu được hexan, chứng tỏ có 6 nguyên tử C trong phân tử glucozơ tạo thành một mạch không nhánh. Vậy : Glucozơ là hợp chất tạp chức, gồm 5 nhóm OH và anđêhit đơn chức. CTCT : CH2OH-CHOH-CHOH-CHOH-CHOH-CH=O hoặc CH2OH[CHOH]4CHO * Dạng mạch vòng : tồn tại chủ yếu ở 2 dạng mạch vòng 6 cạnh : α – glucozơ và β – glucozơ. |
Dạng mạch hở : Là hợp chất tạp chức gồm 5 nhóm OH và 1 nhóm xeton. CH2OH–CHOH– CHOH–CHOH– CO–CH2OH *Dạng mạch vòng : tồn tại chủ yếu 2 dạng vòng 5 cạnh α – fructozơ và β – fructozơ. |
| IV/ Điều chế và ứng dụng |
1. Điều chế: Trong công nghiệp, glucozơ được điều chế bằng cách : + Thủy phân tinh bột, xúc tác axit clohiđric loãng hoặc enzim. + Thủy phân xenlulozơ (trong vỏ bào, mùn cưa,...) , xúc tác HCl đặc hoặc H2SO4 đặc 2. Ứng dụng: + Là chất dinh dưỡng, làm thuốc tăng lực cho người già, trẻ em và người ốm. + Dùng để tráng gương, tráng ruột phích, nguyên liệu sản xuất ancol etylic ... |
+ Saccarozơ là thực phẩm quan trọng của con người. + Trong công nghiệp thực phẩm : là nguyên liệu để làm bánh kẹo, nước giải khát, đồ hộp. + Trong công nghiệp dược phẩm : được dùng để pha thuốc. + Là nguyên liệu để thủy phân thành glucozơ và fructozơ dùng trong kĩ thuật tráng gương, tráng ruột phích. |
| III. Tính chất hóa học |
1. Tính chất của ancol đa chức: a/ Tác dụng với Cu(OH)2: Ở nhiệt độ thường, glucozơ phản ứng với Cu(OH)2 cho phức đồng glucozơ (C6H11O6)2Cu màu xanh lam (tương tự glixerol). 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + 2H2O b/ Phản ứng tạo este : Glucozơ có thể tạo este chứa 5 gốc axit axetic trong phân tử khi tham gia phản ứng với anhiđrit axetic (CH3CO)2O, có mặt piriđin. 2. Tính chất của anđehit : a/ Oxi hóa glucozơ bằng dung dịch AgNO3/NH3 (phản ứng tráng bạc): Dung dịch AgNO3 trong NH3 đã oxi hóa glucozơ tạo thành muối amoni gluconat và Ag kim loại bám vào thành ống nghiệm → thành ống nhiệm sáng bóng như gương. HOCH2[CHOH]4CHO + 2AgNO3 + 3NH3 + H2O → HOCH2[CHOH]4COONH4 + 2Ag ↓ + 2NH4NO3 b/ Oxi hóa glucozơ bằng Cu(OH)2: Trong môi trường kiềm, Cu(OH)2 oxi hóa glucozơ tạo thành muối natri gluconat, đồng (I) oxit và H2O . HOCH2[CHOH]4CHO + 2Cu(OH)2 + NaOH → HOCH2[CHOH]4COONa + Cu2O ↓ + 3H2O c/ Khử glucozơ bằng hiđro: CH2OH[CHOH]4CHO + H2 → CH2OH[CHOH]4CH2OH (sobitol) 3. Phản ứng lên men : C6H12O6 → 2C2H5OH + 2CO2 ↑ |
+ Tương tự glucozơ, fructozơ tác dụng với Cu(OH)2 cho dung dịch phức (C6H11O6)2Cu màu xanh lam (tính chất của ancol đa chức), cộng hiđro cho poliancol C6H14O6 (tính chất của nhóm cacbonyl). + Tương tự glucozơ, fructozơ bị oxi hóa bởi dung dịch AgNO3 trong NH3 và bởi Cu(OH)2 trong môi trường kiềm. Đây là phản ứng của nhóm chức anđehit xuất hiện do trong môi trường bazơ, fructozơ chuyển hóa thành glucozơ. |
| IV. Điều chế và ứng dụng |
1. Điều chế: Trong công nghiệp, glucozơ được điều chế bằng cách : + Thủy phân tinh bột, xúc tác axit clohiđric loãng hoặc enzim. + Thủy phân xenlulozơ (trong vỏ bào, mùn cưa,...) , xúc tác HCl đặc hoặc H2SO4 đặc 2. Ứng dụng: + Là chất dinh dưỡng, làm thuốc tăng lực cho người già, trẻ em và người ốm. + Dùng để tráng gương, tráng ruột phích, nguyên liệu sản xuất ancol etylic ...
|
1. Điều chế: Trong công nghiệp, glucozơ được điều chế bằng cách : + Thủy phân tinh bột, xúc tác axit clohiđric loãng hoặc enzim. + Thủy phân xenlulozơ (trong vỏ bào, mùn cưa,...) , xúc tác HCl đặc hoặc H2SO4 đặc 2. Ứng dụng: + Là chất dinh dưỡng, làm thuốc tăng lực cho người già, trẻ em và người ốm. + Dùng để tráng gương, tráng ruột phích, nguyên liệu sản xuất ancol etylic ... |
CHƯƠNG III : AMIN – AMINO AXIT – PEPTIT VÀ PROTEIN
BÀI 1 : AMIN
I/ Khái niệm, phân loại, đồng phân, danh pháp:
1. Khái niệm: Khi thay thế nguyên tử H trong phân tử NH3bằng gốc hiđrocacbon ta thu được amin.
2. Phân loại:
3. Theo gốc hiđrocacbon:
- Amin mạch hở: CH3NH2 , C2H5NH2 , …
- Amin không no: CH2 = CH – NH2 , …
- Amin thơm và amin có vòng thơm : C6H5NH2 , C6H5CH2NH2 , CH3C6H4NH2 , …
Theo bậc của amin :
(**) Bậc của amin thường được tính bằng số gốc hiđrocacbon liên kết với nguyên tử nitơ hoặc tính bằng số nguyên tử H trong phân tử NH3 bị thay thế.
Ví dụ :
+ Amin bậc 1 như C2H5NH2 , C6H5NH2 , …
+ Amin bậc 2 như CH3 – NH – CH3 , C2H5 – NH – C2H5 , …
+ Amin bậc 3 như ...
Đồng phân, danh pháp : Tên các amin thường được gọi theo tên gốc – chức (gốc hiđrocacbon + chức amin) và tên thay thế.
- Tên thay thế :
+ Với amin bậc 1: vị trí nhánh - tên nhánh + tên mạch chính (ankan tương ứng) – vị trí nhóm amin + “amin” .
+ Với amin bậc 2 và 3 : chọn mạch dài nhất làm mạch chính, N có chỉ số vị trí nhỏ nhất. Đặt một nguyên tử N trước mỗi nhóm thế của amin + tên gốc + tên mạch chính (ankan tương ứng) – vị trí nhóm amin + “amin” .
Tên gốc chức : tên gốc + “amin”.
...................................
Để xem và tải toàn bộ tài liệu Lý thuyết hóa 12 học kì 1 đầy đủ chi tiết nhất mời các bạn ấn link TẢI VỀ phía dưới.