Giải Hóa 10 bài 17: Phản ứng oxi hóa - khử
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập trang 82, 83 SGK Hóa học lớp 10: Phản ứng oxi hóa - khử, với nội dung tài liệu được cập nhật chi tiết và đầy đủ sẽ giúp các bạn học sinh có kết quả cao hơn trong học tập. Mời thầy cô cùng các bạn học sinh cùng tham khảo.
Giải bài tập Hóa 10 Bài 17: Phản ứng oxi hóa - khử
Mời các bạn tham khảo một số tài liệu liên quan
A. Tóm tắt Hóa 10 bài 17: Phản ứng oxi hóa - khử
I. Phản ứng oxi hóa - khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Ví dụ:
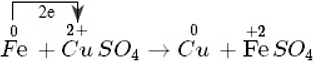
Quá trình thay đổi số oxi hóa:
Fe0 → Fe2+ + 2e
- Số oxi hóa của sắt tăng từ 0 đến +2. Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự oxi hóa nguyên tử sắt.
- Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự oxi hóa nguyên tử sắt.
Cu2+ + 2e → Cu
- Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự khử ion đồng.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
⇒ Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.
II. Lập phương trình hóa học của phản ứng oxi hóa khử
Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
III. Ý nghĩa của phản ứng oxi hóa – khử
- Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên:
Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
- Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử.
Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, ... đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.
B. Giải bài tập Hóa 10 trang 82
Bài 1 trang 82 sgk hóa 10
Cho phản ứng sau:
A. 2HgO ![]() \(\overset{t^{0} }{\rightarrow}\) 2Hg + O2.
\(\overset{t^{0} }{\rightarrow}\) 2Hg + O2.
B. CaCO3 ![]() \(\overset{t^{0} }{\rightarrow}\) CaO + CO2.
\(\overset{t^{0} }{\rightarrow}\) CaO + CO2.
C. 2Al(OH)3 ![]() \(\overset{t^{0} }{\rightarrow}\) Al2O3 + 3H2O.
\(\overset{t^{0} }{\rightarrow}\) Al2O3 + 3H2O.
D. 2NaHCO3 ![]() \(\overset{t^{0} }{\rightarrow}\) Na2CO3 + CO2 + H2O.
\(\overset{t^{0} }{\rightarrow}\) Na2CO3 + CO2 + H2O.
Phản ứng nào là phản ứng oxi hóa - khử.
Hướng dẫn giải
Những phản ứng theo đề bài cho, phản ứng oxi hóa - khử là: A.
2HgO ![]() \(\overset{t^{0} }{\rightarrow}\) 2Hg + O2.
\(\overset{t^{0} }{\rightarrow}\) 2Hg + O2.
Còn các phản ứng khác không phải là phản ứng oxi hóa khử
Bài 2 trang 82 sgk hóa 10
Cho các phản ứng sau:
A. 4NH3 + 5O2 → 4NO + 6H2O.
B. 2NH3 + 3Cl2 → N2 + 6HCl.
C. NH3 + 3CuO → 3Cu + N2 + 3H2O.
D. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4.
Ở phản ứng nào NH3 không đóng vai trò chất khử?
Hướng dẫn giải
Phản ứng NH3 không đóng vai trò chất khử.
D. 2NH3 +H2O2 + MnSO4 → MnO2 + (NH4)2SO4.
Bài 3 trang 83 sgk hóa 10
Trong số các phản ứng sau:
A. HNO3 + NaOH → NaNO3+ H2O.
B. N2O5 + H2O → 2HNO3.
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O.
D. 2Fe(OH)3 → Fe2O3 + 3H2O.
Phản ứng nào là phản ứng oxi hóa - khử.
Hướng dẫn giải
Trong các phản ứng trên chỉ có phản ứng C là phản ứng oxi hóa - khử vì có sự thay đổi số oxi hóa của các nguyên tố.
Bài 4 trang 83 sgk hóa 10
Trong phản ứng 3NO2 + H2O → 2HNO3 + NO. NO2 đóng vai trò gì?
A. Chỉ là chất oxi hóa.
B. Chỉ là chất khử.
C. Là chất oxi hóa, nhưng đồng thời cũng là chất khử.
D. Không là chất oxi hóa, không là chất khử.
Chọn đáp án đúng.
Hướng dẫn giải
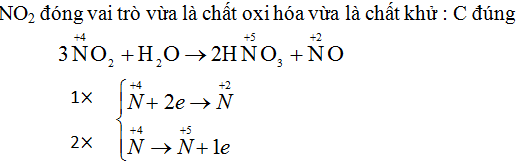
Bài 5 trang 83 sgk hóa 10
Phân biệt chất oxi hóa và sự oxi hóa, chất khử và sự khử. Lấy thí dụ để minh họa.
Hướng dẫn giải:
Chất oxi hóa là chất nhận electron.
Sự oxi hóa một chất là làm cho chất đó nhường electron.
Chất khử là chất nhường electron.
Sự khử một chất là sự làm cho chất đó thu electron.
Thí dụ:
![]()
- Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự oxi hóa nguyên tử sắt.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Bài 6 trang 83 sgk hóa 10
Thế nào là phản ứng oxi hóa - khử? Lấy ba thí dụ.
Hướng dẫn giải
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự chuyển electron gữa các chất phản ứng
Thí dụ:
Ho2 + Clo2 ![]() \(\overset{as}{\rightarrow}\) 2H+1Cl -1
\(\overset{as}{\rightarrow}\) 2H+1Cl -1
Fe + 2HCl → Fe+2Cl2 + H2
2FeCl2 + Clo2 → 2Fe+ 3Cl-13
Bài 7 trang 83 sgk hóa 10
Lập phương trình phản ứng oxi hóa - khử sau đây theo phương pháp thăng bằng electron:
a) Cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O.
b) Cho Cu tác dụng với dung dịch axit HNO3 đặc, nóng thu được Cu(NO3)2, NO2, H2O.
c) Cho Mg tác dụng với dung dịch axit H2SO4 đặc, nóng thu được MgSO4, S và H2O.
Hướng dẫn giải
Các phương trình hóa học là.
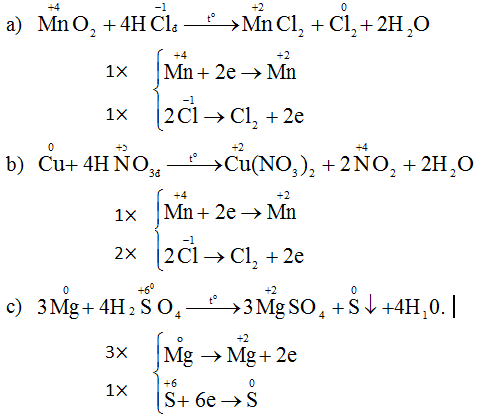
Bài 8 trang 83 sgk hóa 10
Cần bao nhiêu gam đồng để khử hoàn toàn lượn ion bạc có trong 85ml dung dịch AgNO3 0,15M?
Hướng dẫn giải bài tập
nAgNO3= 0,15 x 85 / 1000 = 0,01275 mol.
Phương trình hóa học của phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
nCu= 1/2 nAgNO3 = 0,01275 /2 = 0,006375 mol.
mCu tham gia phản ứng: 0,006375 × 64 = 0,408 g.
>> Mời các bạn tham khảo thêm giải hóa 10 bài 18 tại: Giải Hóa 10 bài 18: Phân loại phản ứng trong hóa học vô cơ
-------------------------
Trên đây VnDoc đã giới thiệu Giải Hóa 10 bài 17: Phản ứng oxi hóa - khử tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.




