Trắc nghiệm: Axit tác dụng với bazơ
Chuyên đề Hóa học lớp 9: Trắc nghiệm: Axit tác dụng với bazơ được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập: Axit tác dụng với bazơ
Bài 1: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magiê giải phóng khí hidrô
D. Không làm đổi màu quỳ tím
Bài 2: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ
D. Màu xanh đậm thêm dần
Bài 3: Cho 200ml dung dịch KOH 1M tác dụng với 200ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:
A. 2,24 lít B. 4,48 lít C. 3,36 lít D. 6,72 lít
Bài 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 400 ml B. 350 ml C. 300 ml D. 250 ml
Bài 5: Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là:
A. 0,3 mol B. 0,4 mol C. 0,6 mol D. 0,9 mol
Bài 6: Trung hòa 200 g dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là:
A. 200g B. 300g C. 400g D. 500g
Bài 7: Trung hoà hoàn toàn 200ml dung dịch KOH 0,5M bằng 200g dung dịch HCl a%. Nồng độ phần trăm của dung dịch (a%) là:
A. 1,825% B. 3,650% C. 18,25% D. 36,50%
Bài 8: Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 g B. 16,475 g C. 17,475 g D. 18,645 g
Bài 9: Cho 200ml dung dịch KOH 1M tác dụng với 300ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:
A. 2,24 lít B. 4,48 lít C. 3,36 lít D. 6,72 lít
Bài 10: Để trung hoà 200ml H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 400 ml B. 350 ml C. 300 ml D. 100 ml
Đáp án và hướng dẫn giải
| 1. A | 2. C | 3. A | 4. D | 5. A |
| 6. D | 7. A | 8. C | 9. B | 10. D |
Bài 1: Theo bài ta có:
nBa(OH)2 = 0,1.0,1 = 0,01 mol
nHCl = 0,1.0,1 = 0,01 mol
Theo PTHH, ta có:
Ba(OH)2 + 2HCl → BaCl2 + H2O
Bđ…...................0,01 …..…0,01…………………….. mol
Pư……………….0,005……..0,01……0,005…………mol
Sau pư………….0,005……….0……….0,005………..mol
Vậy sau phản ứng bazo Ba(OH)2 còn dư → dd sau phản ứng có môi trường bazo
→ Làm quỳ tím hóa xanh.
⇒ Chọn A.
Bài 2: HCl trung hòa bazo KOH làm dd chuyển dần từ màu xanh sang không màu, đến khi HCl dư, dd lại chuyển từ không màu sang màu đỏ.
⇒ Chọn C.
Bài 3:
2KOH + H2SO4 → K2SO4 + 2H2O (1)
Mg + H2SO4 → MgSO4 + H2 (2)
Theo bài ta có:
nKOH = 0,2.1 = 0,2 mol
nH2SO4 = 0,2.1 = 0,2 mol
Theo phương trình (1) ta có:
nKOH pư = 0,2 mol
nH2SO4 = 1/2 nKOH = 0,1 mol
nH2SO4 dư (1) = 0,2-0,1 = 0,1 mol
Theo phương trình (2) ta có:
nMg pư = nH2SO4 dư (1) = nH2 = 0,1 mol
→ VH2 = 0,1.22,4 = 2,24 mol
⇒ Chọn A.
Bài 4:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O (1)
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O (2)
Theo bài, ta có:
Theo PTPU, ta có:
nBa(OH)2(1) = 1/2 nHCl = 0,03 mol
nBa(OH)2(2) = nH2SO4 = 0,02 mol
nBa(OH)2 can = nBa(OH)2(1) + nBa(OH)2(2) =0,05 mol
VBa(OH)2 can = 0,05/0,2 = 0,25 lit = 250ml
⇒ Chọn D.
Bài 5:
3NaOH + H3PO4 → Na3PO4 + 3H2O
⇒ mBaSO4 ↓ = 0,075.223 = 17,475 g
Theo PTHH, ta có:
nH3PO4 = 1/3 nNaOH = 0,3 mol = a
⇒ Chọn A.
Bài 6:
NaOH + HCl → NaCl + H2O
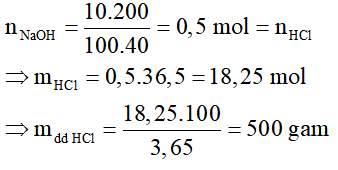
⇒ Chọn D.
Bài 7: Tương tự bài 6.
⇒ Chọn A.
Bài 8:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Theo bài ta có:
nBa(OH)2 = 0,4.0,2 = 0,08 mol
nH2SO4 = 0,3.0,25 = 0,075 mol
Theo PTHH ta có:
nH2SO4 = nBa(OH)2 pư = 0,075 mol = nBaSO4↓
mBaSO4↓ = 0,075.223= 17.475 g
⇒ Chọn C.
Bài 9: Tương tự bài 3.
⇒ Chọn B.
Bài 10: Tương tự bài 4.
⇒ Chọn D.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 9: Trắc nghiệm: Axit tác dụng với bazơ. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.







