Oxit bazơ tác dụng với axit
Chuyên đề Hóa học lớp 9: Oxit bazơ tác dụng với axit được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Oxit bazơ tác dụng với axit
I/ Lý thuyết và phương pháp giải
Oxit bazơ + axit → muối + nước
VD: FeO + H2SO4 → FeSO4 + H2O
CuO + HCl → CuCl2 + H2O
Phương pháp giải bài tập oxit bazơ tác dụng với axit:
- Bước 1: Viết PTHH.
- Bước 2: Tính toán theo PTPU (có thể đặt ẩn).
- Bước 3: Tính toán theo yêu cầu của đề bài.
II/ Bài tập vận dụng
Bài 1: Cho 4,48g oxit bazơ CaO tác dụng vừa đủ với axit H2SO4. Sau khi cô cạn sản phẩm, thu được bao nhiêu gam muối khan?
Hướng dẫn:
- Bước 1: Viết PTHH
CaO + H2SO4 → CaSO4 + H2O
- Bước 2: Tính toán theo PTPU
Theo phương trình phản ứng: nCaO = nCaSO4
Theo đề bài:
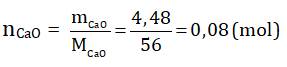
⇒ nCaSO4 = 0,08 (mol)
- Bước 3: Tính toán theo yêu cầu của đề bài
Vậy mmuối khan = mCaSO4 = 0,08.136 = 10,88 (gam)
Bài 2: Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml H2SO4 0,1 M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là bao nhiêu?
Hướng dẫn:
♦ Cách 1 (Áp dụng định luật bảo toàn khối lượng)
- Bước 1: Viết PTHH
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (1)
MgO + H2SO4 → MgSO4 + H2O (2)
ZnO + H2SO4 → ZnSO4 + H2O (3)
- Bước 2+3: Tính toán theo PTPU và tính kết quả theo yêu cầu của đề bài
Từ 3 PTHH trên, ta thấy nH2SO4 = nH2O = 0,1.0,5 =0,05 (mol)
Theo định luật bảo toàn khối lượng, ta có:
moxit + mH2SO4 = mmuối + mH2O
⇒ mmuối =(moxit + mH2SO4) - mH2O= (2,81 + 0,05.98) – 0,05.18 = 6,81 g
Vậy khối lượng muối khan thu được sau phản ứng là 6,81 g
♦ Cách 2 (Phương pháp tăng giảm khối lượng)
Áp dụng tăng giảm khối lượng, ta thấy 1 O được thay thế bởi 1 nhóm SO4:
Fe2O3 → Fe2(SO4)3
MgO → MgSO4
ZnO → ZnSO4
⇒ 1 mol oxit tăng 96-16 = 80 g
⇒ Khối lượng muối sau phản ứng là:
mmuối = moxit + nH2SO4 . 80 =2,81 + 0,1.0,5.80 = 6,81 g
Nhận xét:
-Trong phản ứng của oxit bazơ tác dụng với axit H2SO4 thì nH2SO4 = nH2O
⇒ Tương tự, trong phản ứng của oxit bazơ tác dụng với axit HCl thì nHCl = 2.nH2O
VD: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
-Trong bài toán oxit bazơ tác dụng với axit ta có thể áp dụng phương pháp bảo toàn khối lượng.
moxit + maxit = mmuối + mnước
-Trong bài toán oxit bazơ tác dụng với axit ta có thể áp dụng phương pháp tăng giảm khối lượng.
⇒ Với axit H2SO4, ta có công thức: mmuối = moxit + 80. nH2SO4
⇒ Với axit HCl, ta có công thức: mmuối clorua = moxit + 27,5.nHCl
Bài 3: Hòa tan hoàn toàn 2,8 gam hỗn hợp gồm Fe2O3, MgO, CuO cần dùng 200 ml HCl 0,5M. Hỗn hợp muối clorua khan thu được khi cô cạn dd có khối lượng là bao nhiêu?
Hướng dẫn:
♦ Cách 1 (Áp dụng định luật bảo toàn khối lượng)
Ta biết nHCl = 2.nH2O = 0,5.0,2 = 0,1 (mol)
⇒ nH2O = 0,05 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
moxit + maxit clohiđric = mmuối clorua + mnước
mmuối clorua = (moxit + maxit clohiđric) - mnước
mmuối clorua = (2,8 + 0,1.36,5) - 0,05.18 = 5,55 g
Vậy khối lượng muối khan thu được là 5,55 g.
♦ Cách 2 (Phương pháp tăng giảm khối lượng)
Ta có: nHCl = 0,2.0,5 = 0,1 mol.
Áp dụng công thức
mmuối clorua = moxit + 27,5.nHCl
mmuối clorua = 2,8 + 27,5.0,1 = 5,55 g
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Oxit bazơ tác dụng với axit gồm các khái niệm, tính chất vật lý, hóa học của các oxit bazo tác dụng với axit.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 9: Oxit bazơ tác dụng với axit. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.







