Trắc nghiệm: Hỗn hợp kim loại tác dụng với axit
Chuyên đề Hóa học lớp 9: Trắc nghiệm: Hỗn hợp kim loại tác dụng với axit được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Trắc nghiệm: Hỗn hợp kim loại tác dụng với axit
Bài 1: Hòa tan 13,2g hỗn hợp X gồm hai kim loại có cùng hóa trị vào 200ml dung dịch HCl 3M. Cô cạn dung dịch sau phản ứng thu được 23,85g hỗn hợp muối khan. Tính thể tích hiđro sinh ra.
A. 1,12 lit B. 3,36 lit C. 4,48 lit D. 4,84 lit
Bài 2: Hòa tan hết 11,2g hỗn hợp gồm hai kim loại X (hóa trị x) và Y (hóa trị y) trong dung dịch HCl rồi sau đó cô cạn dung dịch thu được 39,6g muối khan. Tính thể tích khí hidro sinh ra là?
A. 8,96 lít B. 1,12 lít C. 0,986 lít D. 3,36 lít
Bài 3: Thí nghiệm 1: cho a gam Fe hòa tan trong dung dịch HCl, sau khi cô cạn dung dịch thu được 3,1 gam chất rắn.
Thí nghiệm 2: cho a gam Fe và b gam Mg vào dung dịch HCl (cùng với lượng như trên) sau khi cô cạn dung dịch thì thu được 3,34g chất rắn và 448ml H2.Tính a, b.
A. 1,68 g và 0,42 g B. 0,42 g và 1,68 g
C. 1,68 g và 0,24 g D. 0,24 g và 1,68 g
Bài 4: Cho 13g hỗn hợp A gồm Cu, Al, Mg vào dung dịch HCl dư, phản ứng xong thu được 4 gam chất rắn không tan và 10,08 lít khí H2 (đktc). Tính thành phần phần trăm theo khối lượng của từng kim loại trong hỗn hợp.
A. 30,77%; 27,69%; 41,54%
B. 27,69%; 41,54%; 30,77%
C. 30,77%; 41,54%; 27,69%
D. 27,69%; 30,77%;41,54%
Bài 5: Lấy 20,05 gam hỗn hợp Al + Fe2O3 cho tác dụng với axit sunfuric loãng, dư thì có 5,04 lít khí sinh ra. Trộn 20,05g hỗn hợp đầu trong bình kín rồi nung nóng để thực hiện phản ứng nhiệt nhôm. (Thể tích khí đo ở đktc). Tính khối lượng các chất thu được sau phản ứng nhiệt nhôm.
Chú ý: Phản ứng nhiệt nhôm 2Al + Fe2O3 → Al2O3 + 2Fe
A. mFe2O3 (ban đầu) = 16g; mFe2O3 (dư) = 4g
B. mFe2O3 (ban đầu) = 4g; mFe2O3 (dư) = 16g
C. mFe2O3 (ban đầu) = 8g; mFe2O3 (dư) = 12g
D. Đáp án khác
Bài 6: Cho 10,5g hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Tính khối lượng chất rắn còn lại sau phản ứng.
A. 3 g B. 4 g C. 5 g D. 6 g
Bài 7: Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư, người ta thu được 0,56 lít khí (đktc). Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu.
A. 32,5% và 65,7% B. 65,7% và 32,5%
C. 67,5% và 32,5% D. 32,5% và 67,5%
Bài 8: A là hỗn hợp gồm: Ba, Al, Mg. Lấy m gam A cho tác dụng với nước tới khi hết phản ứng thấy thoát ra 3,36 lít H2 (đktc). Lấy m gam A cho vào dung dịch xút dư tới khi hết phản ứng thấy thoát ra 6,72 lít H2 (đktc). Lấy m gam A hoà tan bằng một lượng vừa đủ dung dịch axit HCl thì thu được một dung dịch và 8,96 lít H2 (đktc). Hãy tính m gam.
A. 24, 56 g B. 24,65 g C. 25,46 g D. 25,64 g
Bài 9: Hoà tan hỗn hợp gồm Fe, Zn trong 500ml dung dịch HCl 0,4M được dung dịch A và 10,52g muối khan. Tính thể tích dung dịch B gồm NaOH 0,02M và Ba(OH)2 cần dùng để trung hoà dung dịch A.
A. 0,5 lít B. 0,75 lít C. 1 lít D. 1,5 lít
Bài 10: Hoà tan 5,2g hỗn hợp gồm Mg và Fe bằng dung dịch axit HCl 1M, thì thu được 3,36 lít H2 (đktc). Tính thể tích dung dịch axit HCl đã dùng.
A. 200 ml B. 300 ml C. 400 ml D. 500 ml
Đáp án và hướng dẫn giải
| 1. B | 2. A | 3. C | 4. C | 5. A |
| 6. B | 7. D | 8. B | 9. C | 10. B |
Bài 1:
mmuoi = mKL - mCl-
⇒ mCl- = mmuoi - mKL = 23,85 - 13,2 = 10,65g
⇒ nCl- = 10,65/35,5 = 0,3 mol
⇒ nH2 = 1/2 nCl- = 0,15 mol
⇒ V = 0,15.22,4 = 3,36 lít
⇒ Chọn B.
Bài 2: Tương tự bài 1.
⇒ Chọn A.
Bài 4:
2Al + 6HCl → 2AlCl3 + 3H2
a………………………….3/2.a (mol)
Mg + 2HCl → MgCl2 + H2
b..........................................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
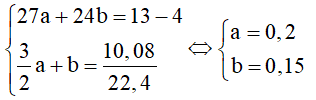
⇒ %mCu = 4/13.100 = 30,77%
⇒ %mAl = 0,2.27/100 = 41,54%
⇒ %mMg = 100% - 30,77% - 41,54% = 27,69%
⇒ Chọn C.
Bài 5:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
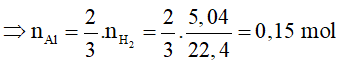
⇒ mFe2O3(bđ) = 20,05 - 0,15.27 = 16g
⇒ nFe2O3(bđ) = 16/160 = 0,1 mol
2Al + Fe2O3 → Al2O3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ mFe2O3(dư) = 0,025.160=4g
⇒ Chọn A.
Bài 6:
Zn + H2SO4 → ZnSO4 + H2
Cu không tác dụng với axit Sunfuric.
⇒ nZn = nH2 = 2,24/22,4 = 0,1 mol
⇒ mZn = 0,1.65 = 6,5g
⇒ mCu = mran con lai = 10,5 - 6,5 =4g
⇒ Chọn B.
Bài 7:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x 3/2 x mol
Fe + H2SO4 → FeSO4 + H2
y y mol
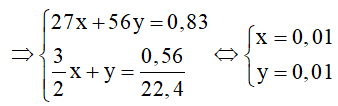
⇒ %mAl = 0,01.27/0,83 . 100 = 32,53%
⇒ %mFe = 100-32,53 = 67,47%
⇒ Chọn D.
Bài 10: Tương tự bài 7.
⇒ Chọn B.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 9: Trắc nghiệm: Hỗn hợp kim loại tác dụng với axit. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.







